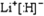题目内容
 下表是元素周期表的前三周期:
下表是元素周期表的前三周期:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J | K |
(1)写出下列元素的元素符号:D
N
N
、KAr
Ar
.(2)G元素与F元素形成的化合物的化学式是
NaF
NaF
、它是离子
离子
(填“离子”或“共价”)化合物.(3)非金属性最强的元素是
F
F
,I和J最高价氧化物对应水化物的酸性强弱关系是H2SO4
H2SO4
<HClO4
HClO4
.(填化学式)(4)写出化合物A2E2的电子式
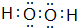
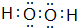
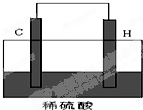
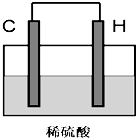
(5)将H单质与C的一种单质(导体)按如图装置连接,对该装置判断正确的是
C
C
A.C极是原电池的负极,发生还原反应
B.C极是原电池的正极,发生氧化反应
C.H极是原电池的负极,发生氧化反应
D.H极是原电池的正极,发生还原反应
(6)下列判断正确的是
B
B
A、原子半径:B<C<D<E<F B、氢化物稳定性:C<D
C、G能从H的盐溶液中置换出H D、简单阴离子的还原性:I<J.
分析:由元素在周期表中的物质可知,A为H、B为Li、C为碳、D为氮、E为氧、F为氟、G为Na、H为Al、I为硫、J为Cl、K为Ar,
(1)D为氮、K为Ar;
(2)G元素与F元素形成的化合物为氟化钠,由活泼金属与活泼非金属组成,属于离子化合物;
(3)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属性最强的元素处于第二期ⅦA族,为氟元素;非金属性越强最高价含氧酸的酸性越强;
(4)化合物A2E2为H2O2,分子中氧原子之间形成1对共用电子对、氧原子与氢原子之间形成1对共用电子对;
(5)原电池反应为2Al+3H2SO4=Al2(SO4)2+3H2↑,负极反应氧化反应,正极发生还原反应;
(6)A.同周期自左而右原子半径减小;
B.非金属性越强氢化物越稳定;
C.钠与盐溶液反应,是钠与水反应,不能将金属从盐溶液中置换出来;
D.非金属性越强,阴离子还原性越弱.
(1)D为氮、K为Ar;
(2)G元素与F元素形成的化合物为氟化钠,由活泼金属与活泼非金属组成,属于离子化合物;
(3)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属性最强的元素处于第二期ⅦA族,为氟元素;非金属性越强最高价含氧酸的酸性越强;
(4)化合物A2E2为H2O2,分子中氧原子之间形成1对共用电子对、氧原子与氢原子之间形成1对共用电子对;
(5)原电池反应为2Al+3H2SO4=Al2(SO4)2+3H2↑,负极反应氧化反应,正极发生还原反应;
(6)A.同周期自左而右原子半径减小;
B.非金属性越强氢化物越稳定;
C.钠与盐溶液反应,是钠与水反应,不能将金属从盐溶液中置换出来;
D.非金属性越强,阴离子还原性越弱.
解答:解:由元素在周期表中的物质可知,A为H、B为Li、C为碳、D为氮、E为氧、F为氟、G为Na、H为Al、I为硫、J为Cl、K为Ar,
(1)D为氮,其元素符号为N,K为Ar,故答案为:N;Ar;
(2)G元素与F元素形成的化合物为NaF,属于离子化合物,故答案为:NaF;离子;
(3)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属性最强的元素处于第二期ⅦA族,为氟元素;非金属性Cl>S,故酸性H2SO4<HClO4,
故答案为:F;H2SO4、HClO4;
(4)化合物A2E2为H2O2,分子中氧原子之间形成1对共用电子对、氧原子与氢原子之间形成1对共用电子对,其电子式为: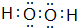 ,
,
故答案为: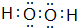 ;
;
(5)原电池反应为2Al+3H2SO4=Al2(SO4)2+3H2↑,H极为Al,发生氧化反应,作负极,C极为碳,作正极,发生还原反应,故C正确,故答案为:C;
(6)A.同周期自左而右原子半径减小,故原子半径原子半径:B>C>D>E>F,故A错误;
B.同周期自左而右非金属性减弱,非金属性越强氢化物越稳定,故氢化物稳定性:C<D,故B正确;
C.钠与盐溶液反应,是钠与水反应,不能将金属从盐溶液中置换出来,故C错误;
D.非金属性J>I,非金属性越强,阴离子还原性越弱,故简单阴离子的还原性:I>J,故D错误;
故答案为:B.
(1)D为氮,其元素符号为N,K为Ar,故答案为:N;Ar;
(2)G元素与F元素形成的化合物为NaF,属于离子化合物,故答案为:NaF;离子;
(3)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故非金属性最强的元素处于第二期ⅦA族,为氟元素;非金属性Cl>S,故酸性H2SO4<HClO4,
故答案为:F;H2SO4、HClO4;
(4)化合物A2E2为H2O2,分子中氧原子之间形成1对共用电子对、氧原子与氢原子之间形成1对共用电子对,其电子式为:
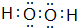 ,
,故答案为:
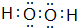 ;
;(5)原电池反应为2Al+3H2SO4=Al2(SO4)2+3H2↑,H极为Al,发生氧化反应,作负极,C极为碳,作正极,发生还原反应,故C正确,故答案为:C;
(6)A.同周期自左而右原子半径减小,故原子半径原子半径:B>C>D>E>F,故A错误;
B.同周期自左而右非金属性减弱,非金属性越强氢化物越稳定,故氢化物稳定性:C<D,故B正确;
C.钠与盐溶液反应,是钠与水反应,不能将金属从盐溶液中置换出来,故C错误;
D.非金属性J>I,非金属性越强,阴离子还原性越弱,故简单阴离子的还原性:I>J,故D错误;
故答案为:B.
点评:本题考查元素周期表与元素周期律的综合应用,难度不大,侧重对基础知识的考查,注意基础知识的理解掌握.

练习册系列答案
相关题目
 下表是元素周期表的前三周期:
下表是元素周期表的前三周期: