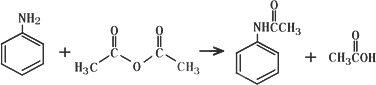
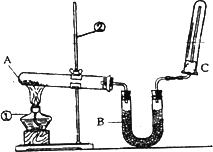
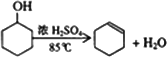
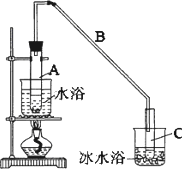
0 88307 88315 88321 88325 88331 88333 88337 88343 88345 88351 88357 88361 88363 88367 88373 88375 88381 88385 88387 88391 88393 88397 88399 88401 88402 88403 88405 88406 88407 88409 88411 88415 88417 88421 88423 88427 88433 88435 88441 88445 88447 88451 88457 88463 88465 88471 88475 88477 88483 88487 88493 88501 203614