题目内容
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如下图所示.
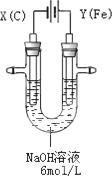
Ⅰ.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(1)电解过程中,X极是________极,电极反应是________.
(2)电解过程中,Y极放电的有________.
(3)生成高铁酸根(FeO42-)的电极反应是________.
Ⅱ.若用不同种电池作为上述实验的电源,请分析电池反应.
(1)铅蓄电池总的化学方程式为:
Pb+PbO2+2H2SO4![]() 2H2O+2PbSO4,则它在充电时的阳极反应为________.
2H2O+2PbSO4,则它在充电时的阳极反应为________.
(2)镍镉碱性充电电池在放电时,其两极的电极反应如下:
正极:2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-
负极:Cd+2OH——2e-=Cd(OH)2
则它在放电时的总反应的化学方程式为________.
(3)肼(N2H4)是一种可燃性液体,可用作火箭燃料.已知在25℃、101 kPa时,32.0 g N2H4在氧气中完全燃烧生成氮气和液态水,放出624 kJ的热量,则N2H4完全燃烧的热化学方程式是________;
肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,放电时负极的电极反应是________.
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O.写出该电池正极的电极反应:________.
(5)当制备相同物质的量的高铁酸钾时,理论上,上述四种电池中分别消耗的Pb、Cd、肼、丙烷的物质的量之比是________.
解析:
|
Ⅰ.(1)阴;2H++2e-=H2↑. (2)Fe和OH- (3)Fe+8OH――6e-=FeO42-+4H2O Ⅱ.(1)PbSO4+2H2O-2e-=PbO2+SO42-+4H+ (2)Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2 (3)N2H4(1)+O2(g)=N2(g)+2H2O(l) ΔH=-624kJ/mol N2H4+4OH――4e-=4H2O+N2↑ (4)O2+2CO2+4e-=2CO32- (5)10∶10∶5∶1 |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
| A.有强氧化性,可消毒杀菌,还原产物水解后能吸附水中杂质 |
| B.有强还原性,可消毒杀菌,氧化产物水解后能吸附水中杂质 |
| C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 |
| D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |




