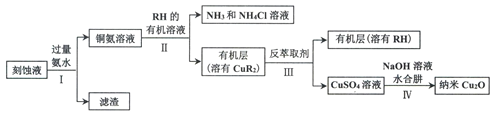
【题目】由下列实验及现象能推出相应结论的是
实验操作及实验现象 | 结 论 | |
A | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应[FeCl3+ 3KSCN |
B | 向做了相同标记的2支试管中均加入2mL 0.1mol/L Na2S2O3溶液,再分别向2支试管中加入4mL浓度为0.1mol/L、0.5mol/L 的H2SO4溶液,测定恰好遮挡全部标记所用时间 | 其他条件一定时,反应物浓度越大,化学反应速率越快 |
C | 室温下,用广泛pH试纸测定0.1 mol/L Na2SO3溶液的pH为10,0.1mol/L NaHSO3溶液的pH为5 | 相同条件下,HSO3-的水解能力强于SO32- |
D | 向2 mL0.1mol/LAgNO3溶液中加入1mL0.1mol/LNaCl溶液,生成白色沉淀,再加入1mL0.1mol/L KI溶液,生成黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A.AB.BC.CD.D
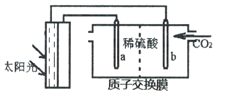
【题目】二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00molCO2和2.0 mol H2以及催化剂发生反应:CO2(g)+H2 (g)![]() HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
60 min | 90 min | 120 min | 150 min | 180 min | ||
实验I | Tl/K | 1.50 mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
实验Ⅱ | T2/K | 1.45 mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)比较实验温度T1___T2(填“>”、“<”),该反应的ΔH___0(填“>”、“=”、“<”)。
(2)实验I中0~60 min内用HCOOH表示的该反应的平均反应速率为_____。
(3)实验Ⅱ反应开始时体系压强为P0,第90min时体系压强为Pl,则Pl∶P0=___。
(4)比较实验I、Ⅱ在80min时的逆反应速率大小vl___vⅡ(填“>”、“<”或“无法判断”),原因是_____。