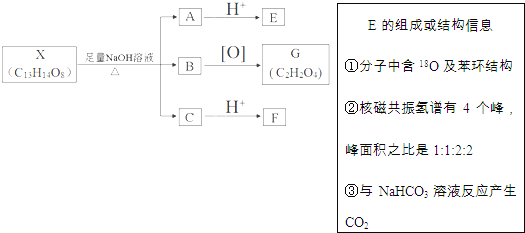
【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。
已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;常温下H2C2O4为晶体,易溶于水,溶解度随温度升高而增大。

请回答:
(1)步骤②,发生反应的离子方程式____________________________;该步骤H2C2O4稍过量主要是为了_________________。
(2)下列操作或描述正确的是_______________。
A.步骤①,酸化主要是为了抑制Fe2+水解
B.步骤③,如果采用冷水洗涤可提高除杂效果
C.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(3)称取一定量的FeC2O4·2H2O试样,用硫酸溶解,采用KMnO4滴定法测定,折算结果如下:
n(Fe2+)/mol | n(C2O42-)·mol-1 | 试样中FeC2O4·2H2O的质量分数 |
9.80×10-4 | 9.80×10-4 | 0.98 |
由表中数据推测试样中最主要的杂质是_________________。
(4)实现步骤④必须用到的两种仪器是_________(供选仪器如下)
a.坩埚;b.烧杯;c.蒸馏烧瓶;d.锥形瓶;e.表面皿:f.高温炉
该步骤的化学方程式是______________________________________________。
【题目】甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) △H=-49.0 kJ·mol-1
2CH3OH(g)=CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
H2O(l)=H2O(g) △H= + 44 kJ·mol-1
则CO2与H2反应合成二甲醚生成液态水的热化学方程式为:____________________。
(2)工业上合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是___________
A.v正(H2) = 2v逆(CH3OH) B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变 E.容器的压强不变
(3)若反应2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如下表所示:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度(mol·L-1) | 0.44 | 0.60 | 0.60 |
①比较该时刻正、逆反应速率的大小:v(正)_____v(逆)(填“>”、“<”或“=”)。
②若加入甲醇后,经10 min反应达到平衡,则平衡后c(CH3OH)=______________,
该时间内反应速率v(CH3OCH3)=_____________。
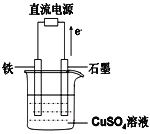
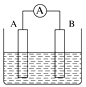
(4)利用二甲醚(CH3OCH3)设计一个燃料电池,用KOH溶液作电解质溶液,石墨做电极,该电池负极电极反应式为___________________________。以此燃料电池作为外接电源按如图所示电解硫酸铜溶液,如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入______其质量约为_____g。