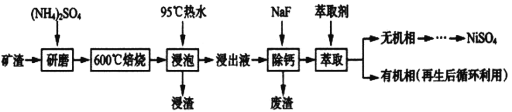
题目内容
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法正确
A.该化合物仅含碳、氢两种元素B.该化合物中碳、氢原子个数比为1:3
C.无法确定该化合物是否含有氧元素D.该化合物中一定含有氧元素
【答案】D
【解析】
该化合物6.4 g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O,6.4g化合物中碳元素的质量为![]() , 6.4g化合物中氢元素的质量为
, 6.4g化合物中氢元素的质量为![]() ,碳元素和氢元素的质量之和为3.2g,还含有氧元素,所以氧元素的质量为: 6.4g-3.2g=3.2g,化合物中C、H、O原子的个数比为:
,碳元素和氢元素的质量之和为3.2g,还含有氧元素,所以氧元素的质量为: 6.4g-3.2g=3.2g,化合物中C、H、O原子的个数比为: ![]() 。
。
A.该化合物含碳、氢两种元素,还含有氧元素,A错误;
B.该化合物中碳、氢原子个数比为1: 4,B错误;
C.从分析可知,可以确定该化合物中含有氧元素,C错误;
D.该化合物中一定含有氧元素,D正确;
答案选D。

练习册系列答案
相关题目
【题目】下列实验方案不能达到实验目的是
实验目的 | 实验方案 | |
A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反产生的气体通入溴的四氯化碳溶液 |
B | 检验卤代烃中卤原子的种类 | 将溴乙烷与氢氧化钠溶液共热,取冷却后反应液,向其中滴加硝酸酸化后的硝酸银溶液 |
C | 检验 | 将 |
D | 验证苯和液溴在 | 将反应产生的混合气体先通入四氯化碳溶液再通入 |
A.AB.BC.CD.D