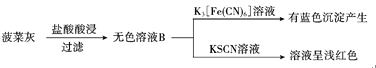
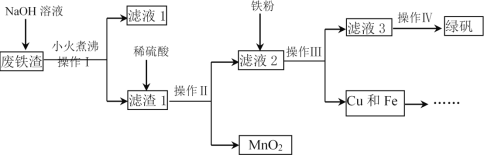
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

根据题意回答下列问题:
(1)实验中需用1mo/L的硫酸800mL,若用18.4mol/L的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为____________
A.10mL B.20mL C.50mL D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为_________________。
(3)滤渣的主要成分中除含有Fe(OH)3、Al(OH)3外还有________________。
(4)在“除钙”前,需检验滤波中Fe3+是否被除尽,简述检验方法:______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤: “操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,__________,便得到了MgSO4·7H2O。
(6)实验中提供的硼镁泥共10g,得到的MgSO4·7H2O为17.22g,则MgSO4·7H2O的产率为__________________。
【题目】Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
(查阅资料)① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O![]() Cu(SO3)23-(无色)
Cu(SO3)23-(无色)
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式: ____Cu2++ ____SO32-+ ____ =____Cu2O↓+ ____ + ____HSO3-
(实验探究)
操作 | 现象 |
| i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_______。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是______。
(5)iii中砖红色沉淀消失的原因是_______。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_______。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______、_______。
【题目】二氧化氯(ClO2)是一种新型消毒剂,可用氯酸钠(NaClO3)为原料制备。
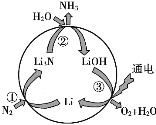
(1)隔膜电解法制备ClO2的装置示意图如下:

已知:ClO2在酸性溶液中比较稳定,在碱性溶液中不能稳定存在。
①产生O2的电极反应式:________。
②结合反应方程式,简述ClO2的产生过程:_________。
(2)过氧化氢还原法制备ClO2:![]() 研究发现Cl-对上述反应有影响,实验记录如下:
研究发现Cl-对上述反应有影响,实验记录如下:
加入NaCl 的浓度/(g·L1) | ClO2的生成速率/(g·L-1·min-1) | 相同时间 | |||
10 min | 30 min | 60 min | ClO2 产率/% | Cl2 的量 | |
0 | 0.0035 | 0.0124 | 0.0159 | 97.12 | 极微量 |
1.00 | 0.0138 | 0.0162 | 0.0163 | 98.79 | 极微量 |
①NaCl的主要作用是_______。
②上述反应可能的过程如下:
反应i:![]() +
+ ![]() + +
+ +
反应ii: Cl2 + H2O2 = 2Cl- + O2↑ + 2H+
将反应i填写完整_________。
③进一步研究发现,未添加Cl-时,体系中首先会发生反应生成Cl-,反应为:ClO3- + 3H2O2 = Cl- + 3O2↑+3H2O(反应iii)。分析反应i、ii、iii的速率大小关系并简要说明理由:_________。
(3)国家规定,饮用水中ClO2的残留量不得高于0.8 mg·L-1,检测步骤如下:
Ⅰ.取1.0L的酸性水样,加入过量的碘化钾,再用氢氧化钠溶液调至中性,使ClO2转化为![]() 。加入淀粉溶液,溶液变蓝。
。加入淀粉溶液,溶液变蓝。
Ⅱ.用0.0010 mol/LNa2S2O3溶液滴定步骤I中产生的I2。已知:步骤II中发生反应的离子方程式是![]()
①步骤I中发生的氧化还原反应的离子方程式是________。
②当步骤II中出现________(填现象)时,停止滴加Na2S2O3溶液,记录其体积为10.00 mL。
③上述水样中ClO2的残留浓度是______mg·L-1。