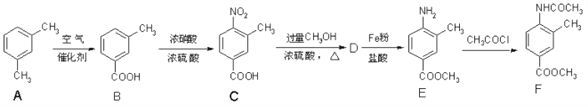
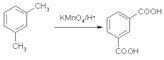
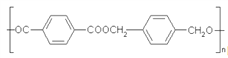
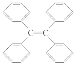
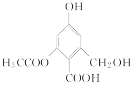
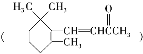
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是

①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D
【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;iv、其他。请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
n+m | 2 | ________ |
VSEPR理想模型 | ________ | 正四面体 |
价层电子对之间的理想键角 | ________ | 109°28′ |
(2)请用VSEPR模型解释CO2为直线型分子的原因_________________________________;
(3)H2O分子的立体构型为:___________________,请你预测水分子中∠H-O-H的大小范围并解释原因______________________________________________________________;
(4)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型:_____________________________, SO2Cl2分子中∠Cl-S-Cl________________(选填“<”、“>”或“=”)SO2F2分子中∠F-S-F。
(5)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
分子或 离子 | PbCl2 | XeF4 | SnCl62- | PF3Cl2 | HgCl42- | ClO4-- |
空间 构型 | _____ | _____ | _____ | _____ | _____ | _____ |