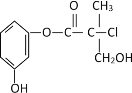
题目内容
【题目】下列有关有机物说法不正确的是( )
A. 等质量的苯乙烯和聚苯乙烯燃烧耗氧量相同
B. 四苯基乙烯(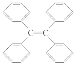 )中所有碳原子一定处于同一平面
)中所有碳原子一定处于同一平面
C. 1 mol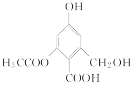 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3 mol、4 mol、1 mol
分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3 mol、4 mol、1 mol
D. 1molβ紫罗兰酮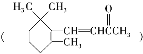 与1molBr2发生加成反应可得3种产物
与1molBr2发生加成反应可得3种产物
【答案】B
【解析】
A. 苯乙烯和聚苯乙烯的最简式都是CH,故等质量的苯乙烯和聚苯乙烯燃烧耗氧量相同,故A正确;
B.单键可以旋转,故每个苯环碳原子与双键碳原子可能共平面,但所有碳原子不一定处于同一平面,故B错误;
C.分子内的酚羟基、醇羟基、羧基都能与Na反应,酚羟基、羧基都能与NaOH反应,且酯基水解后生成的酚羟基、羧基均消耗NaOH,只有羧基与NaHCO3溶液反应,故C正确;
D.  与Br2起加成反应,可以发生1,2-加成反应,也可能发生1,4-加成反应,所以加1mol β-紫罗兰酮
与Br2起加成反应,可以发生1,2-加成反应,也可能发生1,4-加成反应,所以加1mol β-紫罗兰酮 与1mol Br2发生加成反应可得到3种不同产物,故D正确。
与1mol Br2发生加成反应可得到3种不同产物,故D正确。
故答案选B。

【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力主要顺序为:i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;iii、X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;iv、其他。请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表:
n+m | 2 | ________ |
VSEPR理想模型 | ________ | 正四面体 |
价层电子对之间的理想键角 | ________ | 109°28′ |
(2)请用VSEPR模型解释CO2为直线型分子的原因_________________________________;
(3)H2O分子的立体构型为:___________________,请你预测水分子中∠H-O-H的大小范围并解释原因______________________________________________________________;
(4)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测 SO2Cl2和SO2F2分子的立体构型:_____________________________, SO2Cl2分子中∠Cl-S-Cl________________(选填“<”、“>”或“=”)SO2F2分子中∠F-S-F。
(5)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
分子或 离子 | PbCl2 | XeF4 | SnCl62- | PF3Cl2 | HgCl42- | ClO4-- |
空间 构型 | _____ | _____ | _____ | _____ | _____ | _____ |
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),属于过渡元素的是___(该空格用表中的字母表示)。
(2)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。
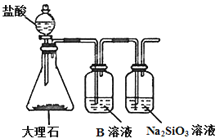
(3)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为_________。