题目内容
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1) 春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式__________,将54.8g Na2CO3和NaHCO3的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=__,气体V=___。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为_______,若有2mol氯气参与该反应,则此时转移的电子数为___NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为______。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为_______。
【答案】Na2CO3+H2O+CO2=2NaHCO3 0.2mol 6.72L Cl2+2OH-=Cl-+ClO-+H2O 2 HCO3-+H+=CO2↑+H2O K2O·Al2O3·6SiO2
【解析】
(1)碳酸钠与二氧化碳在溶液中反应生成碳酸氢钠;加热发生反应:2NaHCO3![]() Na2CO3+H2O+CO2↑,计算分解生成二氧化碳物质的量,根据方程式计算每一份中碳酸氢钠的物质的量,原混合物中碳酸氢钠的物质的量为每一份中碳酸氢钠的2倍,可得原混合物中碳酸钠的质量,进而计算原混合物中碳酸钠的物质的量,根据碳原子守恒计算每一份与盐酸反应生成二氧化碳的体积;
Na2CO3+H2O+CO2↑,计算分解生成二氧化碳物质的量,根据方程式计算每一份中碳酸氢钠的物质的量,原混合物中碳酸氢钠的物质的量为每一份中碳酸氢钠的2倍,可得原混合物中碳酸钠的质量,进而计算原混合物中碳酸钠的物质的量,根据碳原子守恒计算每一份与盐酸反应生成二氧化碳的体积;
(2)氯气和NaOH反应生成NaCl和NaClO,根据氯气和转移电子之间的关系式计算转移电子物质的量;
(3)小苏打的主要成分为碳酸氢钠,可与盐酸反应生成二氧化碳气体;
(4)根据化学式改写成相应的氧化物的形式,按照活泼金属氧化物较活泼金属氧化物SiO2H2O的顺序来书写,并要遵守原子守恒。
(1)碳酸钠与二氧化碳在溶液中反应生成碳酸氢钠,反应方程式为:Na2CO3+H2O+CO2=2NaHCO3;
加热生成二氧化碳的物质的量为:2.24L÷22.4L/mol=0.1mol,由2NaHCO3![]() Na2CO3+H2O+CO2↑,可知每一份中碳酸氢钠的物质的量为:0.1mol×2=0.2mol,故原混合物中碳酸氢钠的物质的量为0.2mol×2=0.4mol,则原混合物中m(Na2CO3)=54.8g0.4mol×84g/mol=21.2g,则原混合物中n(Na2CO3)=21.2g÷106g/mol=0.2mol;
Na2CO3+H2O+CO2↑,可知每一份中碳酸氢钠的物质的量为:0.1mol×2=0.2mol,故原混合物中碳酸氢钠的物质的量为0.2mol×2=0.4mol,则原混合物中m(Na2CO3)=54.8g0.4mol×84g/mol=21.2g,则原混合物中n(Na2CO3)=21.2g÷106g/mol=0.2mol;
每一份中碳酸氢钠为0.2mol,碳酸钠为0.1mol÷2=0.1mol,根据碳原子守恒,可知与盐酸反应生成二氧化碳为:(0.2mol+0.1mol)×22.4L/mol=6.72L;
(2)氯气和NaOH反应生成NaCl和NaClO,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,反应中Cl元素化合价由0价分别变化为+1价、1价,若有2mol氯气参与该反应,则生成2molNaCl,转移电子物质的量为2mol,数目为2NA;
(3)小苏打的主要成分为碳酸氢钠,可与盐酸反应生成二氧化碳气体,反应的离子方程式为HCO3-+H+=CO2↑+H2O;
(4)钾的氧化物为K2O,铝的氧化物为Al2O3,硅的氧化物为SiO2,则根据活泼金属氧化物、较活泼金属氧化物、SiO2、H2O的顺序可知,KAlSi3O8可改写为K2O·Al2O3·6SiO2.

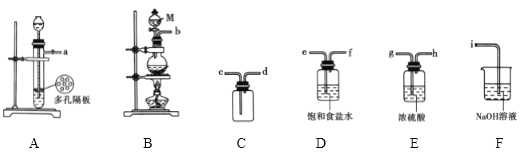
【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |