题目内容
【题目】如下流程中a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物。下列有关说法正确的是( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A. 若a的相对分子质量是42,则d是乙醛
B. 若d的相对分子质量是44,则a是乙炔
C. 若a为苯乙烯(C6H5—CH===CH2),则f的分子式是C16H18O2
D. 若a为单烯烃,则d与f的最简式一定相同
【答案】D
【解析】
A项,相对分子质量42的烃为C3H6,则b可为1-溴丙烷,c为1-丙醇,d为丙醛,e为丙酸,故A项错误;
B项,若d的相对分子质量是44,则经过O2/Cu反应后,d可能为CH3CHO,c为CH3CH2OH,b为CH3CH2Br,a为乙烯,故B项错误;
C项,若a为C6H5—CH=CH2,则b为C6H5—CH2CH2Br,c为C6H5—CH2CH2OH,d为C6H5—CH2CHO,e为C6H5—CH2COOH,f为C6H5—CH2COOCH2CH2C6H5,分子式为C16H16O2,故C项错误;
D项,若a为单烯烃,则d为一元醛,f为一元酯,若a的分子式为CnH2n(n![]() 2),则d的分子式为CnH2nO,f的分子式为C2nH4nO2,最简式为CnH2nO,二者最简式相同,故D项正确。
2),则d的分子式为CnH2nO,f的分子式为C2nH4nO2,最简式为CnH2nO,二者最简式相同,故D项正确。
综上所述,本题正确答案为D。

 名校课堂系列答案
名校课堂系列答案【题目】二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用。回答下列问题:
I.实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3)。
(1)盐酸和NaClO3反应时有ClO2和Cl2生成,书写反应的离子方程式并标出电子转移的方向和数目______________________________________,当反应中转移0.2mol电子时,参加反应的还原剂的物质的量为________________________________。
(2)使用双氧水作还原剂的优点是_________________________________________。
II.当pH≤2.0时,NaClO2能被I 完全还原成Cl;(离子反应方程式为ClO2+4H++4I→2I2+Cl+2H2O)。回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6(2Na2S2O3+I2→2NaI+Na2S4O6)。欲测定成品中NaClO2的含量,现进行如下操作:
步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定发生反应 |
(1)步骤Ⅱ加入指示剂的名称是_______________。滴定终点时溶液的颜色变化为_________。
(2)若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为__________(用含W、c、V的代数式表示)。
(3)ClO2和Cl2均能将电镀废水中的CN 氧化为无毒的物质,自身被还原为Cl,处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的___倍。
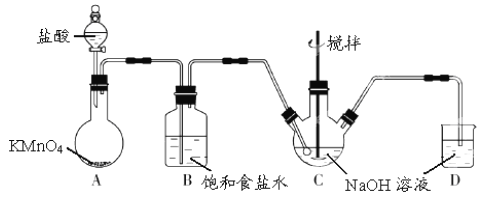
【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是

①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D