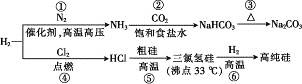
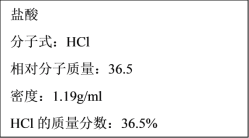
【题目】实验室用63%的浓硝酸(其密度为1.4g/mL)配制240mL0.50mol/L稀硝酸,若实验仪器有:A 10mL量筒 B 50mL量筒 C 托盘天平 D 玻璃棒 E 100mL容量瓶 F 250mL容量瓶 G 500mL容量瓶 H 胶头滴管 I 200mL烧杯。
(1)此浓硝酸的物质的量浓度为____________mol/L
(2)应量取63%的浓硝酸_____________mL,应选用___________。(填仪器的字母编号)
(3)实验时还需选用的仪器有______________(填仪器的字母编号)
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是______(填序号)。 |
A.可以按此建议改进,便于使用容量瓶 |
B.不能按此建议改进,因为会降低容量瓶的精确度 |
C.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响 |
【题目】I.利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):_______________________________________________________________
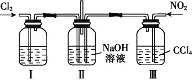
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。

①实验时所需要的玻璃仪器除烧杯、量筒外还需要:_________。
②该装置中有一处错误是:______________________,
(3)用相同浓度和体积的氨水(NH3· H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”或“无影响”)。
Ⅱ.(1)已知充分燃烧一定质量的丁烷(C4H10)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示丁烷燃烧热的热化学方程式为______________________
(2)已知下列热化学方程式:
C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJmol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJmol-1
请写出C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学方程式____________________
(3)已知几种共价键的键能数据如下表:
共价键 | N≡N | H—H | N—H |
键能 (kJ/mol) | 946 | 436 | 390.8 |
写出合成氨反应的热化学方程式: ____________________________________。
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓 度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3B. α1+α3<1C. 2p2<p3D. a+b>92.4
【题目】一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g) + H2O(g) 下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | ||
III | 207 | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C. 容器I中反应到达平衡所需时间比容器III的长
D. 若起始时向容器I中充入0.15mol 的CH3OH、0.15mol 的CH3OCH3和0.10mol 的H2O,则反应将向正反应方向进行