题目内容
【题目】(1)科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类化合物在维生素C的作用下能够转化为有毒的+3价的含砷化合物。通过以上信息填空:上述过程中+5价砷类物质作为______(填氧化剂或还原剂),+5价砷元素发生______反应(填氧化或还原);0.5mol+5价砷完全转化为+3价砷,共转移______个电子。
(2)实验室常用以下方法制取氯气:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
①用双线桥标出电子转移方向和数目______;(在答题纸上标)
②在标准状况下生成的氯气为11.2L时,被氧化的HCl的质量为______;
③为保证实验安全,常用氢氧化钠溶液吸收多余的氯气,写出反应的离子方程式______________________。
【答案】氧化剂 还原 NA 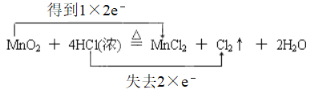 36.5g Cl2+2OH-=Cl-+ClO-+H2O
36.5g Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)食用虾类等水生甲壳类动物中含有+5价砷类物质,与维生素C反应生成+3价砷类化合物,则维生素C具有还原性;根据砷元素的化合价变化进行计算;
(2)反应中Mn元素化合价从+4价降低到+2价,Cl元素化合价从-1价升高到0价,根据化合价升高数=化合价降低数=转移电子数以及氯气有毒分析解答。
(1)由对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化合物,则砷元素的化合价降低,+5价砷类化合物为氧化剂,+5价砷元素发生还原反应;As元素由+5价降为+3价,降低2价,即得到2个电子,则0.5mol+5价砷完全转化为+3价砷时,共得到0.5mol×(5-3)=1mol,1mol电子即转移的电子数为NA。
(2)①反应4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O中,Mn元素化合价从+4价降低到+2价,得到2个电子,Cl元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒可知反应转移2个电子,则电子转移情况可表示为
MnCl2+Cl2↑+2H2O中,Mn元素化合价从+4价降低到+2价,得到2个电子,Cl元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒可知反应转移2个电子,则电子转移情况可表示为 ;
;
②标准状况下11.2LCl2的物质的量为:11.2L÷22.4/L=0.5mol,被氧化的HCl生成Cl2,根据氯原子守恒可知,被氧化的HCl的物质的量是Cl2的2倍,故被氧化的HCl为0.5mol×2=1mol,质量为m=n×M=1mol×36.5g/mol=36.5g;
③氯气有毒为保证实验安全,常用氢氧化钠溶液吸收多余的氯气,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】下表各组物质之间通过一步反应不能实现如图所示转化的是( )
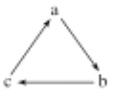
选项 | a | b | c |
A | Si | SiO2 | H2SiO3 |
B | SO2 | SO3 | H2SO4 |
C | NaOH | Na2CO3 | Na2SO4 |
D | NO | NO2 | HNO3 |
A. A B. B C. C D. D
【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()
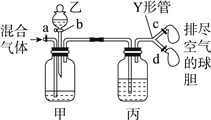
甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D