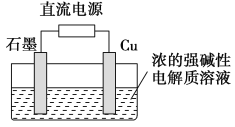
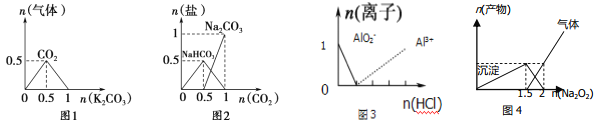【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.
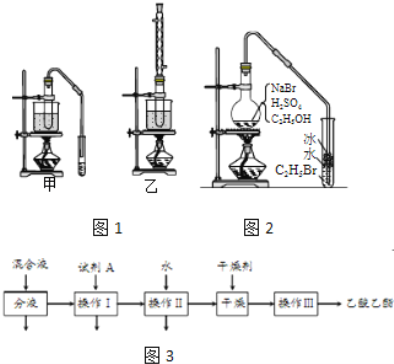
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______.
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是______(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______.(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是______.(选填编号)
物质 | 沸点(℃) |
乙醇 | 78.5 |
乙酸 | 117.9 |
乙酸乙酯 | 77 |
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3,以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物.
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色.与方案①相比较,方案②的明显缺点是______.
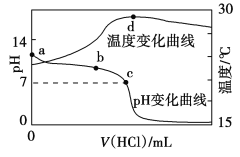
【题目】已知在温度低于570℃ 时,还原铁粉与水蒸气反应的产物是FeO;高于570℃ 时,生成Fe3O4。老师用下图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。

甲同学为探究实验后试管内固体的成分,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
试回答下列问题:
(1)湿棉花的作用是______________。
(2)写出高于570℃ 时,Fe 与水蒸气反应的化学方程式:___________。
(3)乙同学认为加入KSCN 溶液没有出现血红色的原因可能是固体中没有Fe3O4,也有可能是因为___(填物质名称)过量造成的。该物质过量时,溶液中还会发生反应,导致加入KSCN 溶液时没有出现血红色,该反应的离子方程式是______________。
(4)丙同学利用上述实验①加盐酸后的溶液制取白色的Fe(OH)2沉淀,向滤液中加入足量NaOH 溶液后,观察到的实验现象为___。
【题目】高纯二氧化硅可用来制造光纤。某蛇纹石的成分见下表:
组分 | SiO2 | MgO | Na2O | K2O | Fe2O3 |
质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.8 |
通过下图流程可由蛇纹石制备较纯净的二氧化硅。
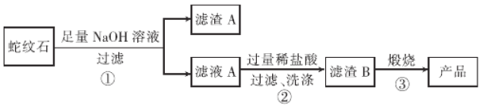
(1)蛇纹石中涉及的可溶性金属氧化物有____________(写化学式)。
(2)步骤①中涉及SiO2反应的离子方程式为________________。
(3)滤渣A 的成分有______________________(填化学式)。
(4)步骤②中洗涤沉淀的方法是_____________________。
(5)步骤③反应的化学方程式为______________________;实验室进行步骤③需要用到的仪器有坩埚、泥三角、酒精灯、玻璃棒、和________________。