题目内容
【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料.
完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______.
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是______(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______.(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
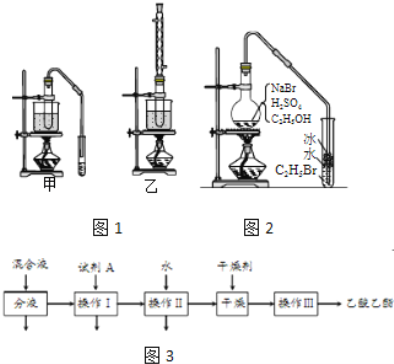
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲乙两套装置如图1都可以选用.关于这两套装置的说法正确的是______.(选填编号)
物质 | 沸点(℃) |
乙醇 | 78.5 |
乙酸 | 117.9 |
乙酸乙酯 | 77 |
a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3,以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物.
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇.
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色.与方案①相比较,方案②的明显缺点是______.
【答案】利用浓硫酸的吸水性,使反应向有利于生成乙烯的方向进行 NaOH d b、d Na2CO3 分液 相互溶解但沸点差别较大的液体混合物 Na2SO3 先加浓硫酸会有较多HBr气体生成,HBr挥发会造成HBr的损耗.
【解析】
(1)乙醇制取乙烯,生成物中含有水,浓硫酸具有吸水性,据此解答即可;
(2)乙醇在浓硫酸作用下生成乙烯,产物中可能含有二氧化硫,二氧化硫存在会对乙烯的验证造成干扰,由于二氧化硫与氢氧化钠反应生成亚硫酸钠,故可以利用氢氧化钠将二氧化硫除去;乙烯与溴水发生加成反应生成而溴乙烷,是油状液体,据此解答即可;
(3)甲装置采取边反应边蒸馏的方法,乙装置则采取直接回流的方法,待反应后再提取产物,所以乙装置更充分反应;
(4)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,干燥后的乙酸乙酯需要精馏;
(5)按方案①和②实验时,产物都有明显颜色,即会有溴单质生成,溶于水形成橙红色;溴化氢具有挥发性,把浓硫酸加入到溴化钠中会有HBr生成,导致HBr损失,据此解答即可。
(1)乙醇制取乙烯,生成物中含有水,浓硫酸具有吸水性,故利用浓硫酸的吸水性,使反应可以向有利于生成乙烯的方向进行;
(2)乙醇在浓硫酸作用下生成乙烯,产物中可能含有二氧化硫,二氧化硫存在会对乙烯的验证造成干扰,由于二氧化硫与氢氧化钠反应生成亚硫酸钠,故可以利用氢氧化钠将二氧化硫除去;乙烯与溴水发生加成反应生成而溴乙烷,是油状液体,故答案为d;
(3)甲装置采取边反应边蒸馏的方法,乙装置则采取直接回流的方法,待反应后再提取产物,所以乙装置更充分反应,乙酸转化率高,故选b、d;
(4)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用分液的方法即可,干燥后的乙酸乙酯中仍混有少许有机物杂质,需要精馏,精馏一般适用于相互溶解但沸点差别较大的液体混合物;
(5)按方案①和②实验时,产物都有明显颜色,即会有溴单质生成,溶于水形成橙红色,溴单质具有氧化性,能与亚硫酸钠反应生成硫酸钠和溴化钠;溴化氢具有挥发性,把浓硫酸加入到溴化钠中会有HBr生成,导致HBr损失。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
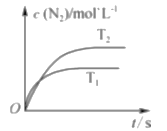
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
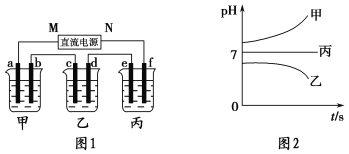
(1)M为直流电源的________极,b电极上发生的电极反应为______________________。
(2)计算e电极上生成的气体在标准状况下的体积为________________。
(3)写出乙烧杯中的总反应方程式:____________________________________________。
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3),过程如下:
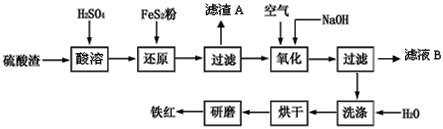
(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是____。
(2)还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:_____。
(3)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是__。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(二)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
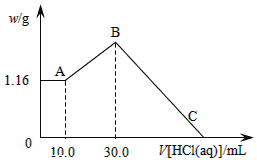
(1)原混合物中NaOH的质量是____g。
(2)C点(此时沉淀恰好完全溶解)HCl溶液的体积为___mL。
(三)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过如图1过程制备ClO2:
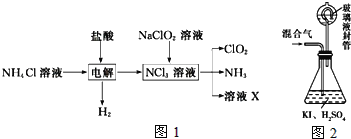
用如图2装置可以测定混合气中ClO2的含量:
Ⅰ、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ、将一定量的混合气体通入锥形瓶中吸收;
Ⅳ、将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ、用0.1000molL1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①测得混合气中ClO2的质量为___g。
②用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___(填标号).
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁