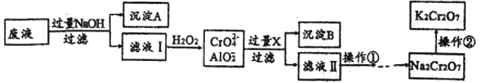
【题目】大多数物质的俗名是根据其特殊的物理性质或用途得来的。下列物质的俗名与化学式或用途不相符的一项是
选项 | 俗名 | 主要成分(化学式) | 用途 |
A | 石英 | SiO2 | 集成电路 |
B | 纯碱 | Na2CO3 | 制备玻璃 |
C | 水玻璃 | Na2SiO3 | 制备硅胶 |
D | 铁红 | Fe2O3 | 用作油漆和涂料 |
A. A B. B C. C D. D
【题目】页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g) + H2O(g)==CO(g)+3H2(g) △H1
已知:
①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O(l) =H2O(g) △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
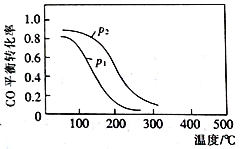
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如右图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如右图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________(填“>”“<”或“ = ”)0。
②写出两条可同时提高反应速率和CO转化率的措施:________________________ 。
③下列说法正确的是____________(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
C.容器内气体压强不再变化时,反应达到最大限度
D.图中压强p12
④03 min内用CH3OH表示的反应速率v(CH3OH)=_________mol L-1·min-1。
⑤200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为________________。