题目内容
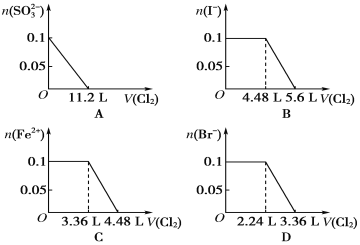
【题目】[2015·上海]工业上将Na2CO3和Na2S以1∶2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A.硫元素既被氧化又被还原
B.氧化剂与还原剂的物质的量之比为1∶2
C.每生成1 mol Na2S2O3,转移4 mol电子
D.相同条件下,每吸收10 m3 SO2就会放出2.5 m3 CO2
【答案】A
【解析】在反应物Na2S中S元素的化合价为2价,在SO2中S元素的化合价为+4价,反应后产生的物质Na2S2O3中,S元素的化合价为+2价,介于2价与+4价之间,因此硫元素既被氧化又被还原,正确。B.根据题意可得在溶液中发生反应的方程式是:Na2CO3+2Na2S+4SO2![]() 3Na2S2O3+CO2,在反应中氧化剂SO2与还原剂Na2S的物质的量之比为4∶2=2∶1,错误。C.根据B选项的反应方程式可知,每生成3 mol Na2S2O3,转移8 mol电子,则产生1 mol Na2S2O3,转移8/3 mol电子,错误。D.根据反应方程式可知消耗的SO2与产生的CO2的物质的量的比是4∶1,但是由于SO2容易溶于水,而CO在水中溶解度较小。所以相同条件下,每吸收10 m3 SO2放出CO2的体积小于2.5 m3,错误。
3Na2S2O3+CO2,在反应中氧化剂SO2与还原剂Na2S的物质的量之比为4∶2=2∶1,错误。C.根据B选项的反应方程式可知,每生成3 mol Na2S2O3,转移8 mol电子,则产生1 mol Na2S2O3,转移8/3 mol电子,错误。D.根据反应方程式可知消耗的SO2与产生的CO2的物质的量的比是4∶1,但是由于SO2容易溶于水,而CO在水中溶解度较小。所以相同条件下,每吸收10 m3 SO2放出CO2的体积小于2.5 m3,错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目