题目内容
【题目】页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g) + H2O(g)==CO(g)+3H2(g) △H1
已知:
①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O(l) =H2O(g) △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
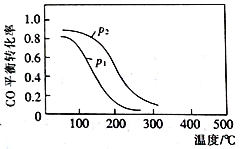
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如右图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如右图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________(填“>”“<”或“ = ”)0。
②写出两条可同时提高反应速率和CO转化率的措施:________________________ 。
③下列说法正确的是____________(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
C.容器内气体压强不再变化时,反应达到最大限度
D.图中压强p12
④03 min内用CH3OH表示的反应速率v(CH3OH)=_________mol L-1·min-1。
⑤200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为________________。
【答案】 -a+3b+c –d < 增大H2浓度,增大压强 cd ![]() (或0.067) 6.25 正向 60%
(或0.067) 6.25 正向 60%
【解析】(1)已知CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1,则有
①CH4(g) + 2O2(g)==CO2(g)+2H2O(l) △H=-a kJmol-1
②H2(g) + 1/2O2(g)==H2O(l) △H=-b kJmol-1
③CO(g) + 1/2O2(g)==CO2(g) △H=-c kJmol-1
④H2O (l) =H2O(g) △H=+dkJmol-1
则根据盖斯定律可知①-②×3-③-④即得到反应CH4(g) + H2O(g)==CO(g)+3H2(g)的△H1=(-a+3b+c –d) kJmol-1。
(2)①随温度的升高CO转化率降低,这说明升高温度平衡向逆反应方向进行,则正反应是放热反应,因此△H2<0。②由于正反应是体积减小的放热反应,则可同时提高反应速率和CO转化率的措施为增大H2浓度,增大压强。③a.升高温度平衡向逆反应方向进行,因此温度越高,该反应的平衡常数越小,a错误;b.达平衡后再充入稀有气体,反应物浓度不变,CO的转化率不变,b错误;c.正反应体积减小,则容器内气体压强不再变化时,反应达到最大限度,即达到平衡状态,c正确;D.正反应体积减小,增大压强平衡向正反应方向进行,CO转化率增大,所以图中压强p1<p2,d正确,答案选cd;④03 min内消耗氢气是4mol,生成甲醇是2mol,浓度是0.2mol/L,则用CH3OH表示的反应速率v(CH3OH)=0.2mol/L÷3min=1/15mol L-1·min-1。⑤根据方程式可知
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L) 0.4 0.8 0
转化浓度(mol/L) 0.2 0.4 0.2
平衡浓度(mol/L) 0.2 0.4 0.2
所以 200℃时,该反应的平衡常数K =![]() 。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,此时浓度熵=
。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,此时浓度熵=![]() <6.25,所以化学平衡正向移动。
<6.25,所以化学平衡正向移动。
(3)标准状况下通入5.6 L甲烷,甲烷的物质的量是0.25mol,碳元素化合价从-4价升高到+4价,则理论上转移0.25mol×8=2mol电子,测得电路中转移1.2 mol电子,则甲烷的利用率为1.2/2×100%=60%。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】下列实验操作和所用装置能达到实验目的的是
选项 | A | B | C | D |
实验 目的 | 检验蔗糖与浓硫酸反应产物中有CO2 | 证明Fe(NO3)2溶液中存在Fe2+的水解平衡 | 检验某溶液中含有Ag+ | 比较非金属性:S>C>Si |
实验 操作 | 将浓硫酸滴入圆底烧瓶中,再将生成的气体通入澄清石灰水 | 将稀硝酸滴入Fe(NO3)2溶液中 | 向待检液中滴加足量的稀盐酸 | 将稀硫酸滴入锥形瓶中,再将生成的气体通入Na2SiO3溶液中 |
所用 装置 |
|
|
|
|
A. A B. B C. C D. D
【题目】
镁、铜等金属离子是人体内多种酶的辅因子。
(1)Cu位于元素周期表第四周期,铜原子核外电子有____种不同的运动状态,Cu+的核外电子排布式为________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴、阳离子个数比为______,该氧化物的电子式为_______________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4H2O,其结构示意图如下,胆矾晶体存在_____化学键,其中SO42-空间构型是______,采用的杂化方式是______。晶体中H、O、S元素电负性由小到大的顺序为_____(用元素符号表示)。

(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因:_____________________________。
(5)金属Mg的堆积方式是六方最密堆积(如左图所示),其晶胞如右图所示镁原子半径为r㎝,阿伏伽德罗常数为NA,则金属镁的晶体密度为______g/㎝3。(用r、NA表达)






