题目内容
NA表示阿伏加德常数,下列说法中正确的是( )
| A、常温常压下,32g O2中含有的氧分子个数为2NA |
| B、2.4g金属镁与足量的盐酸反应,转移的电子数为2NA |
| C、分子数为NA的CO气体质量为28g |
| D、0.1mol/L 稀硫酸中含有H+个数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、32g氧气的物质的量为
=1mol;
B、2.4g镁的物质的量为0.1mol,完全反应后0.1mol镁失去0.2mol电子;
C、分子数为NA的CO气体的物质的量为1mol,1molCO的质量为28g;
D、稀硫酸溶液的体积不知,无法计算溶液中含有的氢离子的物质的量.
| 32g |
| 32g/mol |
B、2.4g镁的物质的量为0.1mol,完全反应后0.1mol镁失去0.2mol电子;
C、分子数为NA的CO气体的物质的量为1mol,1molCO的质量为28g;
D、稀硫酸溶液的体积不知,无法计算溶液中含有的氢离子的物质的量.
解答:
解:A、32g氧气的物质的量为1mol,含有的氧分子个数为NA,故A错误;
B、2.4g镁的物质的量为0.1mol,0.1mol镁完全反应失去了0.2mol电子,转移的电子数为0.2NA,故B错误;
C、分子数为NA的CO气体的物质的量为1mol,质量为28g,故C正确;
D、没有告诉0.1mol/L稀硫酸的体积,无法计算溶液中含有的氢离子数目,故D错误;
故选C.
B、2.4g镁的物质的量为0.1mol,0.1mol镁完全反应失去了0.2mol电子,转移的电子数为0.2NA,故B错误;
C、分子数为NA的CO气体的物质的量为1mol,质量为28g,故C正确;
D、没有告诉0.1mol/L稀硫酸的体积,无法计算溶液中含有的氢离子数目,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化,注意认真审题,如选项A描述的为氧气分子、选项B数据错误.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
下列离子方程式书写正确的是( )
| A、铵明矾[NH4Al(SO4)2?12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| B、H218O中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
| C、碳酸氢钙溶液中加过量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| D、碳酸钠的水解反应:CO32-+H3O+?HCO3-+H2O |
下列离子方程式书写正确的是( )
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B、铁跟稀硫酸反应:Fe+2H+=Fe2++H2↑ |
| C、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
| D、硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
下列环境问题与化工生产没有直接关系的是( )
| A、雾霾 | B、酸雨 |
| C、土地沙漠化 | D、温室效应 |
室温下,某溶液中水电离出的H+和OH-的物质的量浓度乘积为1×10-26,该溶液中一定不能大量存在的是( )
| A、Cl- | ||
B、HCO
| ||
| C、Na+ | ||
D、NO
|
在密闭容器中,反应X2(g)+Y2(g)?2XY(g)△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )


| A、图Ⅰ是加入适当催化剂的变化情况 |
| B、图Ⅱ是扩大容器体积的变化情况 |
| C、图Ⅲ是升高温度的变化情况 |
| D、图Ⅲ是增大压强的变化情况 |
某温度下,在容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为6mol、3mol和6mol.保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是
( )
( )
| A、均减半 |
| B、均加倍 |
| C、均增加2mol |
| D、均减少2mol |
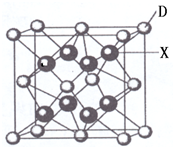 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示). (1)某反应过程中的能量变化如图所示:写出该反应的热化学方程式
(1)某反应过程中的能量变化如图所示:写出该反应的热化学方程式