题目内容
有机物的化学性质主要由其官能团决定.苹果酸是一种有机酸,结构简式为: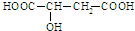 .下列有关苹果酸的说法不正确的是( )
.下列有关苹果酸的说法不正确的是( )
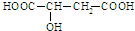 .下列有关苹果酸的说法不正确的是( )
.下列有关苹果酸的说法不正确的是( )| A、1mol苹果酸足量金属钠反应,生成氢气3g |
| B、1mol苹果酸与足量氢氧化钠溶液反应,消耗3mol氢氧化钠 |
| C、1mol苹果酸能与足量的碳酸氢钠溶液反应,标况下生成44.8L的二氧化碳气体 |
| D、苹果酸在一定条件下既能与醋酸反应,又能与乙醇反应,也可以自身发生酯化反应 |
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:分子中含有2个羧基,具有酸性,可发生中和、酯化反应,含有羟基,可发生取代、氧化和消去反应,以此解答.
解答:
解:A.分子中含有2个羟基和1个羧基,则1mol苹果酸足量金属钠反应,生成氢气1.5mol,质量为3g,故A正确;
B.能与氢氧化钠反应的只有羧基,1mol苹果酸与足量氢氧化钠溶液反应,消耗2mol氢氧化钠,故B错误;
C.含有2个羧基,1mol苹果酸能与足量的碳酸氢钠溶液反应,标况下生成2mol,即44.8L的二氧化碳气体,故C正确;
D.分子中含有羟基、羧基,则在一定条件下既能与醋酸反应,又能与乙醇反应,也可以自身发生酯化反应,故D正确.
故选B.
B.能与氢氧化钠反应的只有羧基,1mol苹果酸与足量氢氧化钠溶液反应,消耗2mol氢氧化钠,故B错误;
C.含有2个羧基,1mol苹果酸能与足量的碳酸氢钠溶液反应,标况下生成2mol,即44.8L的二氧化碳气体,故C正确;
D.分子中含有羟基、羧基,则在一定条件下既能与醋酸反应,又能与乙醇反应,也可以自身发生酯化反应,故D正确.
故选B.
点评:本题考查有机物的 结构与性质,为高考高频考点,把握官能团与性质的关系为解答的关键,侧重醇、羧酸性质的考查,选项D为解答的难点,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、燃烧后能生成CO2和H2O的有机物,一定含有碳、氢、氧三种元素 |
| B、所有烷烃中均有碳碳单键 |
| C、属于同分异构体的物质,其分子式相同,分子量相同;但分子量相同的不同物质不一定是同分异构体 |
| D、分子组成相差一个或几个CH2原子团的物质是同系物 |
α鸢尾酮香料的分子结构如图所示,下列说法中不正确的是( )


| A、α鸢尾酮可与某种酚互为同分异构体 |
| B、1 mol α鸢尾酮最多可与3 mol H2加成 |
| C、α鸢尾酮能发生银镜反应 |
D、α鸢尾酮经加氢→消去→加氢可转变为 |
下列物质中,能直接用作半导体材料的是( )
| A、硅 | B、碳 | C、铝 | D、铁 |
X、Y均为短周期元素,其简单离子aXn-和bYm+电子层结构相同,则下列说法正确的是( )
| A、b-a=m+n |
| B、X的原子半径大于Y |
| C、X的族序数小于Y |
| D、X不可能是氢元素 |
下列各组有机化合物的相互关系,判断错误的是( )
A、 和 和 是同一物质 是同一物质 |
| B、CH2=CH2和CH2=CH-CH3互为同系物 |
C、 和 和 互为同系物 互为同系物 |
D、 和 和 互为同分异构体 互为同分异构体 |
以下实验能达到目的是( )
| A、向已经变质的FeCl2溶液中滴加KSCN溶液,溶液变红,则说明FeCl2已完全变质 |
| B、向某一无色气体中通入氧气,气体变红棕色,则证明有NO |
| C、可用PH试纸来测浓硫酸的PH值 |
| D、取某溶液,先后滴入氯化钡溶液和稀硝酸,产生白色沉淀,则该溶液中一定含有SO42- |








