题目内容
15.在密闭容器中进行反应:A(g)+2B(g)?3C(g)+D(s),有关下列图象的说法不正确的是( )| A. | 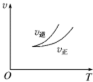 依据图可判断正反应为放热反应 | |
| B. | 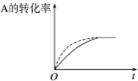 在图中,虚线可表示压缩反应装置体积的情况 | |
| C. | 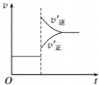 若正反应的△H>0,图可表示升高温度使平衡向逆反应方向移动 | |
| D. | 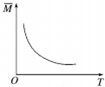 由图中混合气体的平均相对分子质量随温度的变化情况,可推知逆反应的△H<0 |
分析 A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应;
B、变化的条件改变反应速率,缩短反应达到平衡的时间,但是没有改变化学平衡;
C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率;
D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,根据反应气体质量和物质的量的情况来判断.
解答 解:A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应,正向是放热反应,可以判断反应热量变化,故A正确;
B、变化的条件改变反应速率,缩短反应达到平衡的时间,但是没有改变化学平衡,可以是压缩反应装置体积的情况,图象符合改变条件的变化,故B正确;
C、若正反应的△H>0,是吸热反应,升温平衡正向进行,正反应速率大于逆反应速率,图象不符合反应速率的变化,故C错误;
D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,根据反应知道:反应正向进行气体总质量减小,气体物质的量不变,所以温度升高平衡正向进行,正反应是吸热,逆反应△H<0,故D正确;
故选C.
点评 本题考查化学平衡的建立和影响因素的分析判断,图象分析判断是解题关键,题目难度中等.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
6.下列化合物中,在常温常压下以液态形式存在的是( )
| A. | 丙三醇 | B. | 乙炔 | C. | 丙烯 | D. | 丁烷 |
10.在100mL浓度为18mol/L、密度为ρg/mL的浓硫酸中,加入一定量的水,稀释成9mol/L的硫酸,则加入水的体积为( )
| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于$\frac{100}{ρ}$mL |
20.下列金属冶炼的反应原理中错误的是( )
| A. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | B. | Al2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | ||
| C. | Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2 | D. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
 .
.

 .
. .
. .
. .
.
 .
.