题目内容
18.下列叙述正确的是( )| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
分析 A.醋酸溶液中存在电离平衡,加入醋酸钠会抑制醋酸电离;
B.25℃时,等体积等浓度的硝酸与氨水混合后为NH4NO3溶液,溶液中铵根离子水解,溶液呈酸性;
C.硫化氢为弱电解质,而硫化钠为强电解质,等浓度溶液中硫化氢溶液中离子浓度远远小于硫化钠溶液中离子浓度;
D.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,反应生成Na2CO3,碳酸根离子水解溶液显碱性.
解答 解:A.稀醋酸溶液中存在平衡:CH3COOH?CH3COO-+H+,加入醋酸钠,溶液中CH3COO-离子浓度增大,抑制醋酸的电离,故A错误;
B.25℃时,等体积等浓度的硝酸与氨水混合后为NH4NO3溶液,溶液中铵根离子水解,溶液呈酸性,故溶液pH<7,故B错误;
C.硫化氢为弱电解质,部分电离,而硫化钠为强电解质,等浓度溶液中硫化氢溶液中离子浓度远远小于硫化钠溶液中离子浓度,硫化氢溶液比等浓度的硫化钠溶液的导电能力弱,故C正确;
D.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,反应生成Na2CO3,碳酸根离子分步水解溶液显碱性,c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故D错误;
故选C.
点评 本题考查盐类水解、溶液导电性、弱电解质的电离平衡及其影响因素,难度不大,注意电解质溶液中离子浓度大小的比较分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列反应中,属于加成反应的是( )
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | 乙烯使酸性KMnO4溶液褪色 | |
| C. | 将苯滴入溴水中,振荡后水层接近无色 | |
| D. | 甲烷与氯气混合,光照后黄绿色变浅 |
6.两种气态烃的混和物共0.1mol,完全燃烧后得到3.36L(标准状况下)CO2和3.6g水,下列说法正确的是( )
| A. | 可能为甲烷和乙烷的混合物 | B. | 一定有乙烯 | ||
| C. | 混合物中可能含有丙烷 | D. | 两种气态烃一定都有四个H原子 |
3. 2015年科学家首次利用X射线观测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子. 下列关于说法正确的是( )
2015年科学家首次利用X射线观测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子. 下列关于说法正确的是( )
 2015年科学家首次利用X射线观测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子. 下列关于说法正确的是( )
2015年科学家首次利用X射线观测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子. 下列关于说法正确的是( )| A. | CO与CO2均为酸性氧化物 | |
| B. | 大量CO2的排放可导致酸雨的形成 | |
| C. | CO与O形成化学键过程中有电子转移 | |
| D. | 相同条件下,CO的密度比CO2的密度大 |
10. 有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )
有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )
 有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )
有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )| A. | 由B、D制备E常用浓H2SO4作脱水剂 | |
| B. | D、E都能与NaOH溶液反应 | |
| C. | E、D、B三种物质可以用饱和Na2CO3溶液鉴别 | |
| D. | 75%的B溶液常用于医疗消毒 |
7.用NA表示阿伏加德罗常数之值,下列说法正确的是( )
| A. | 2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA | |
| B. | 1molNa2CO3晶体中含CO32-离子数小于NA | |
| C. | 惰性电极电解食盐水,若线路中通过NA电子电量,则阳极产生气体11.2L | |
| D. | 0.1molCaO2(过氧化钙)中含阴离子数是0.2NA |
8.三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )
| A. | 原子数目相等的三种气体,质量最大的是Z | |
| B. | 相同条件下,同质量的二种气体,气体密度最小的是X | |
| C. | 若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1mol | |
| D. | 同温下,体积相同的两容器分别充2 g Y气体和l g Z气体,则其压强比为2:1 |
 .
.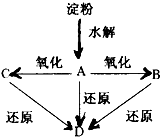 如图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之,
如图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之,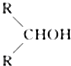 最难.
最难.