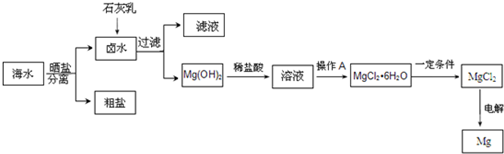
题目内容
7.用NA表示阿伏加德罗常数之值,下列说法正确的是( )| A. | 2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA | |
| B. | 1molNa2CO3晶体中含CO32-离子数小于NA | |
| C. | 惰性电极电解食盐水,若线路中通过NA电子电量,则阳极产生气体11.2L | |
| D. | 0.1molCaO2(过氧化钙)中含阴离子数是0.2NA |
分析 A、金属钠为1价金属,根据电子守恒分析2.3g钠完全反应注意的电子的物质的量;
B、碳酸钠晶体中碳酸根离子的物质的量等于碳酸钠的物质的量;
C、没有告诉是标准状况下,无法计算阳极生成气体的体积;
D、过氧化钙中的阴离子为过氧根离子,0.1mol过氧化钙中含有0.1mol阴离子.
解答 解:A、2.3g金属钠的物质的量为0.1mol,金属钠完全反应失去0.1mol电子,转移电子数均为0.1NA,故A正确;
B、1mol碳酸钠晶体中含有1mol碳酸根离子,含有的碳酸根离子数为1NA,故B错误;
C、惰性电极电解食盐水,若线路中通过1NA电子,电子的物质的量为1mol,阳极生成了0.5mol氯气,由于不是标况下,阳极产生气体的体积无法计算,故C错误;
D、0.1molCaO2中含有0.1mol阴离子O22-离子,所以含有的阴离子数为0.1NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,并准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列叙述正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
15.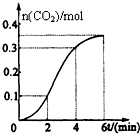 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应2~4分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1mol/(L•min) |
17.有A、B、C、D、E五种短周期元素,其元素特征信息如表:
回答下列问题:(1)写出下列元素的名称:C钠,E氯.
(2)写出A、B、C形成的化合物的电子式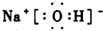 .
.
(3)①写出E单质与A、B、C形成的化合物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O.
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式:2Al+2H2O+2OH-═2AlO2-+3H2↑.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(2)写出A、B、C形成的化合物的电子式
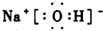 .
.(3)①写出E单质与A、B、C形成的化合物反应的化学方程式:Cl2+2NaOH═NaCl+NaClO+H2O.
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式:2Al+2H2O+2OH-═2AlO2-+3H2↑.
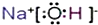 .
.
 ;
;