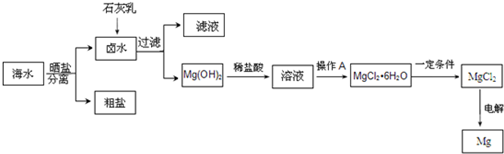
题目内容
6.两种气态烃的混和物共0.1mol,完全燃烧后得到3.36L(标准状况下)CO2和3.6g水,下列说法正确的是( )| A. | 可能为甲烷和乙烷的混合物 | B. | 一定有乙烯 | ||
| C. | 混合物中可能含有丙烷 | D. | 两种气态烃一定都有四个H原子 |
分析 n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,则混合的平均化学式为C1.5H4,因是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,以此解答该题.
解答 解:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,则混合的平均化学式为C1.5H4,因是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,可能为乙烯、丙炔等,选项中只有D符合,故选D.
点评 本题考查分子式的确定、混合物计算,题目难度中等,关键是利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.

练习册系列答案
相关题目
8.下列关于二氧化硅的叙述正确的是( )
| A. | SiO2的用途广泛,主要用途是用于做半导体材料 | |
| B. | SiO2不与任何酸或碱性性氧化物反应 | |
| C. | SiO2和CO2的结构不同,但它们都具有氧化性,都能与强碱反应 | |
| D. | 因为高温时二氧化硅与碳酸钠反应放出CO2,所以硅酸的酸性比碳酸强 |
1.如图为某化学反应的能量-反应进程图,由此可判断该反应( )


| A. | 为放热反应 | B. | 为吸热反应 | C. | 属于燃烧反应 | D. | 属于中和反应 |
18.下列叙述正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
15.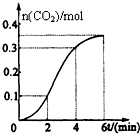 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应2~4分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1mol/(L•min) |
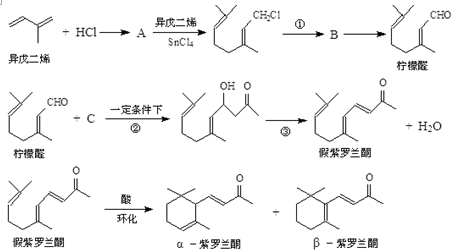
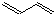 +Cl2$\stackrel{1,4加成}{→}$
+Cl2$\stackrel{1,4加成}{→}$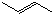
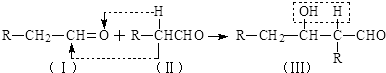
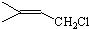 ,C的结构简式
,C的结构简式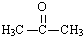 .
.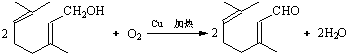 .
.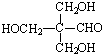 .
.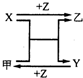 回答下列问题:
回答下列问题: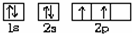 ,乙的电子式为
,乙的电子式为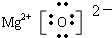 .
.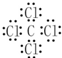 ,乙的化学式为NaCl.
,乙的化学式为NaCl.