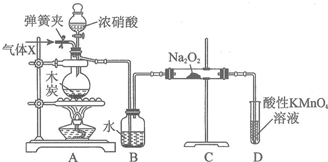
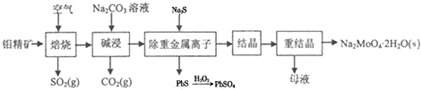
题目内容
2.铜及其化合物在工业上有许多用途.回答下列问题:(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如图1:
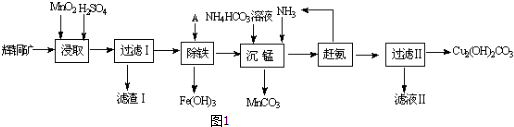
①浸取反应中氧化剂的化学式为MnO2;滤渣Ⅰ的成分为MnO2、S和SiO2(写化学式)
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过2.2 mol/L.(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O.
④滤液Ⅱ经蒸发结晶得到的盐主要是(NH4)2SO4 (写化学式).
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动.
①如图2为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00g,则导线中通过了0.1mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差0.4g
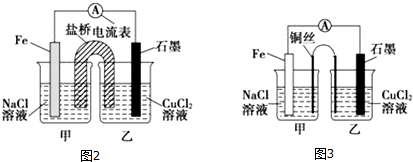
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如图3所示,电流计指针偏转方向与先前一样,但偏转角度明显减小.一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH增大(填“减小”、“增大”或“不变”),乙池中石墨为阴极(填“正”、“负”、“阴”或“阳”)
分析 辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜.
(1)①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,根据方程式判断;
②根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据OH-离子的浓度计算Cu2+离子的浓度;
③“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,以此可书写反应的离子方程式;
④滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体;
(2)①图2为原电池反应,Fe为负极,发生反应:Fe-2e-=Fe2-,石墨为正极,发生反应Cu2++2e-=Cu;根据甲乙两池得失电子相等计算甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量差;
②根他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池.
解答 解:(1)①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,反应中Mn元素化合价降低,被还原,MnO2为氧化剂,因二氧化硅与酸不反应,则滤渣Ⅰ的成分为MnO2、S和SiO2,
故答案为:MnO2;SiO2;
②溶液pH=4,c(OH-)=10-10mol/L,则稀释后的溶液中铜离子浓度最大不能超过$\frac{2.2×1{0}^{-20}}{(1{0}^{-10})^{2}}$mol/L=2.2 mol/L,
故答案为:2.2;
③“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O,
故答案为:Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O;
④滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,
故答案为:(NH4)2SO4;
(2)①图2为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差6g,
则 Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
6g n
则:n=0.1mol,转移0.1mol,甲池:溶解铁为$\frac{0.1mol}{2}$=2.8g,溶液增加2.8g,乙池:析出铜$\frac{0.1mol}{2}$=3.2g,溶液减少3.2g,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差3.2g-2.8g=0.4g,
故答案为:0.1;0.4g;
②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置是电解池,甲装置是原电池,Fe是负极,发生:Fe-2e-=Fe2-,Cu丝是正极,正极发生 O2+2H2O+4e-═4OH-,呈碱性,则甲池铜丝附近溶液的pH增大,乙池中与铜线相连石墨电极是阳极,该极上发生的反应式为2Cl--2e-=Cl2↑,与铁丝相连石墨电极是阴极,发生反应:Cu2++2e-=Cu,
故答案为:增大;阴.
点评 本题考查了物质分离提纯的方法和流程分析应用、原电池、电解池的工作原理以及电极反应式的书写和电子守恒的应用知识,为高频考点,属于综合知识的考查,侧重于学生的分析能力和实验能力、电化学原理应用能力的考查,解答该类题目,注意把握实验、反应原理和操作流程的目的,主要是物质性质的理解,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案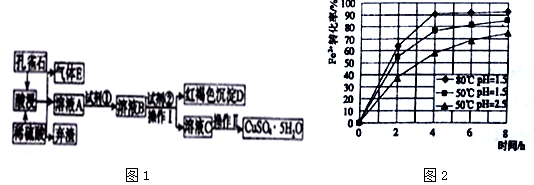
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如表所示:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
(1)弃渣的主要成分是SiO2,Ⅱ中有“洗涤”的操作,其目的是除去晶体表面附着的杂质.
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.试剂①是一种氧化剂,则试剂①最好为下列中的b,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.
a.Na2O2b.H2O2 c.Cl2 d.KSCN
(3)根据图2有关数据,你认为工业上氧化操作时应采取措施将反应温度及溶液pH分别控制在80℃,pH=1.5,氧化时间为4h左右.
(4)操作Ⅰ中溶液的pH应控制在3.2≤pH<4.7范围内.
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液进行滴定,则KMnO4溶液应置于酸(填“酸”或“碱”)式滴定管中.若滴定20.00mLA的溶液,用去0.0240mol•L-1KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+的浓度为0.096mol/L.
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电子式: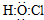 | |
| C. | 氮原子的结构示意图: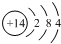 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
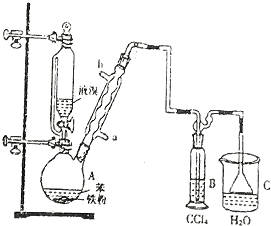
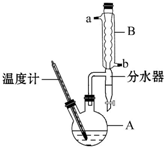 1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如图:
1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如图:已知:Ⅰ.CH3CH2CH2OH+HBr$\stackrel{△}{→}$CH3CH2CH2Br+H2O
Ⅱ.2CH3CH2CH2OH$→_{140℃}^{浓硫酸}$(CH3CH2CH2)2O(正丙醚)+H2O
Ⅲ.可能用到的相关数据如下:
| 相对分 子质量 | 密度 /g•mL-1 | 沸点/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 几乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
①在A中加入50g正丙醇和一定量的浓硫酸、溴化钠一起加热(加入几粒沸石) ②保持69~72℃继续回流2小时 ③蒸馏,收集68~90℃馏出液
④用碳酸钠溶液洗至中性,分液 ⑤再蒸馏,收集68~76℃馏出液,得到纯净1-溴丙烷66g.
请回答:
(1)B装置名称是球形冷凝管,沸石的作用是防止液体暴沸.
(2)步骤①中浓硫酸、正丙醇和溴化钠的添加顺序为先加入正丙醇和溴化钠,再加入浓硫酸.
(3)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(4)为了防止副产物过多,本实验所用硫酸的浓度最好是c.
A.10% B.30% C.70% D.98.3%
(5)步骤④的目的主要是洗去硫酸,振摇后静置,粗产物应从分液漏斗的下(填“上”或“下”)口分离出.
(6)在粗产品蒸馏过程中,不可能用到的仪器有C、D(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶D.球形冷凝管 E.接收器
(7)本实验所得到的1-溴丙烷产率是C(填正确答案标号).
A.41% B.50% C.64% D.70%
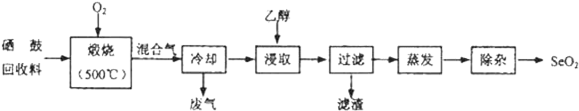
部分物质的物理性质如表:
| 物质 | 熔点 | 沸点 | 溶解度 |
| SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
| TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第四周期ⅥA族;H2Se的热稳定性比H2S的热稳定性弱(填“强”或“弱”).
(2)乙醇浸取后过滤所得滤渣的主要成分是TeO2.蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是升华.
(3)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式H2SeO3+4HI=Se↓+2I2+3H2O.
(4)已知H2SeO3的电离常数K1=3.5×10-3、K2=5.0×10-8,回答下列问题:
①Na2SeO3溶液呈碱性,原因是(用离子方程式表示)SeO32-+H2O?HSeO3-+OH-;
②在Na2SeO3溶液中,下列关系式正确的是C:
A.c(Na+)+c(H+)═c(SeO32-)+c(HSeO3-)+c(OH-)
B.2c(Na+)═c(SeO32-)+c(HSeO3-)+c(H2SeO3)
C.c(Na+)═2c(SeO32-)+2c(HSeO3-)+2c(H2SeO3)
D.c(OH-)═c(H+)+c(HSeO3-)+c(H2SeO3)
| A. | 5:8 | B. | 5:4 | C. | 5:3 | D. | 3:5 |
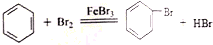 .
.