题目内容
13.用惰性电解电解一定体积的CuSO4溶液一段时间后,发现需加入0.15mol Cu(OH)2才能使溶液恢复到原来状态,则整个电解过程中转移的电子的物质的量为( )| A. | 0.3mol | B. | 0.4mol | C. | 0.5mol | D. | 0.6mol |
分析 Cu(OH)2改写为CuO.H2O,根据“析出什么加入什么”原则知,析出的物质相当于CuO和H2O,所以阴极上有H2、Cu生成,阳极上有O2生成,根据原子守恒得n(O2)=n[Cu(OH)2]=0.15mol,根据氧气和转移电子之间的关系式计算.
解答 解:Cu(OH)2改写为CuO.H2O,根据“析出什么加入什么”原则知,析出的物质相当于CuO和H2O,所以阴极上有H2、Cu生成,阳极上有O2生成,根据原子守恒得n(O2)=n[Cu(OH)2]=0.15mol,根据氧气和转移电子之间关系式知,转移电子物质的量=4n(O2)=0.15mol×4=0.6mol,故选D.
点评 本题以电解原理为载体考查物质的量的有关计算,为高频考点,明确各个物理量关系是解本题关键,注意“加入0.15mol Cu(OH)2才能使溶液恢复到原来状态”说明阴极不仅析出Cu还析出氢气,为易错题.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
3. 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是
A.B.( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是A.B.( )
| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点排序:Y>T>R | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 单质氧化性:Y>R>T |
1.据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:HC≡C-C≡C-C≡C-C≡C-C≡N.对该物质判断正确的是( )
| A. | 不能使溴的四氯化碳溶液褪色 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 不能发生加成反应 | D. | 属于高分子化合物 |
8.LiOH常用于制备锂离子电池正极材料.工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法正确的是( )

| A. | a是电源的负极 | |
| B. | B极区电解液为LiOH溶液 | |
| C. | A电极的电极反应式为4OH--4e-=2H2O+O2↑ | |
| D. | 每产生标准状况下2.24L氢气,就有0.1mol阳离子通过交换膜进入阴极区 |
18.下列A、B两种元素的原子序数,其中可以组成A2B型离子化合物的是( )
| A. | 6和8 | B. | 19和16 | C. | 12和17 | D. | 10和8 |
5.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法正确的是( )
| A. | X的氢化物溶于水显酸性 | |
| B. | Y的氧化物是离子化合物 | |
| C. | Z的氢化物的水溶液在空气中存放不易变质 | |
| D. | X和Z的最高价氧化物对应的水化物可发生中和反应 |
2.胡椒酚是植物挥发油中的一种成分.关于胡椒酚(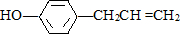 )的下列说法中正确的是( )
)的下列说法中正确的是( )
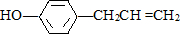 )的下列说法中正确的是( )
)的下列说法中正确的是( )| A. | 该化合物属于芳香烃 | |
| B. | 分子中至少有7个碳原子处于同一个平面 | |
| C. | 它的部分同分异构体能与碳酸氢钠溶液反应产生气体 | |
| D. | 1mol该化合物最多可与2molBr2发生反应 |
3.下列各组物质中化学键的类型完全相同的是( )
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
