题目内容
3.下列各组物质中化学键的类型完全相同的是( )| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
解答 解:A.均只含离子键,故A选;
B.Na2O含离子键,另两种物质含共价键,故B不选;
C.CaCl2只含离子键,NaOH含离子键和共价键,硫酸只含共价键,故C不选;
D.氯化铵含离子键和共价键,另两种物质含共价键,故C不选;
故选A.
点评 本题考查化学键,为高考常见题型,侧重于学生的分析、应用能力的考查,把握化学键的形成及判断的一般规律为解答的关键,注意特殊物质中的化学键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.用惰性电解电解一定体积的CuSO4溶液一段时间后,发现需加入0.15mol Cu(OH)2才能使溶液恢复到原来状态,则整个电解过程中转移的电子的物质的量为( )
| A. | 0.3mol | B. | 0.4mol | C. | 0.5mol | D. | 0.6mol |
14.为了得到比较纯净的物质,下列使用的方法恰当的是( )
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,加热蒸干得NaHCO3晶体 | |
| B. | 加热蒸发CuCl2饱和溶液得纯净的CuCl2晶体 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
11.下列说法中正确的是( )
| A. | 化学性质相似的有机物一定互为同系物 | |
| B. | 分子组成相差一个或几个CH2原子团的有机物一定互为同系物 | |
| C. | 同系物之间相对分子质量一定相差14的整数倍 | |
| D. | 互为同系物的有机化合物可能互为同分异构体 |
18.碳氢化合物是一种大气污染物,下列现象的产生与碳氢化合物有关的是( )
| A. | 臭氧空洞 | B. | 光化学烟雾 | C. | 酸雨 | D. | 火山爆发 |
8.在HAc?H++Ac-的电离平衡中,要使电离平衡向左移动,应采取的措施是( )
| A. | 加HAc | B. | 加NaAc | C. | 加水 | D. | 加NaOH |
15.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 8.4g NaHCO3固体中含有的阴阳离子总数为0.2 NA | |
| B. | 标准状况下,22.4L苯中含有的分子数为NA | |
| C. | 通常状况下,NA 个甲烷分子占有的体积为22.4L | |
| D. | 1L物质的量浓度为1mol/L的Na2CO3溶液中,含有CO32-个数为NA |
12.NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:
Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
(1)前2s内的平均反应速率υ(N2)=2.08×10-4mol/(L•s)(保留3位有效数字,下同);计算此温度下该反应的K=3.65×106.
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂B.降低反应体系的温度
C.充入氩气使容器内压强增大D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO的燃烧热为284kJ/mol或△H=-284kJ/mol.
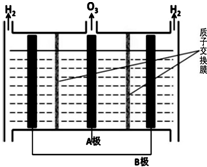
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
(5)O3可由电解稀硫酸制得,原理如图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂B.降低反应体系的温度
C.充入氩气使容器内压强增大D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO的燃烧热为284kJ/mol或△H=-284kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
(5)O3可由电解稀硫酸制得,原理如图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
