题目内容
15.下列有说法正确的是( )①乙醇是可再生的清洁能源
②Na2O是电解质,因其溶于水后能导电
③SiO2不能溶于水,但属于酸性氧化物
④滴加足量稀盐酸产生使澄清石灰水变浑浊的气体,则原溶液中一定含CO32-或SO32-
⑤除去AlCl3溶液中MgCl2的杂质,可向溶液中先加入过量NaOH溶液,过滤后用盐酸调节溶液至中性.
| A. | ①② | B. | ①③ | C. | ①③④ | D. | ①③⑤ |
分析 ①人类开发利用后,在相当长的时间内,不可能再生的自然资源叫不可再生资源.主要指自然界的各种矿物、岩石和化石燃料;可再生的能源泛指从自然界获取的,可以再生的非化石能源;
②Na2O的水溶液可以导电,电离出阴阳离子的是NaOH而不是Na2O;
③二氧化硅不能溶于水,但与氢氧化钠反应生成盐与水;
④能使澄清石灰水变浑浊的气体是CO2和SO2,和酸反应生成CO2和SO2的离子有CO32-、SO32-、HCO3-或HSO3-;
⑤氯化铝为强酸弱碱盐,溶液呈酸性,偏铝酸钠为强碱弱酸盐,最后中性为氯化钠溶液.
解答 解:①酒精是一种可再生能源.酒精燃烧产生二氧化碳和水属于比较清洁的能源,故①正确;
②Na2O的水溶液可以导电,Na2O+H2O=2NaOH,所以电离出阴阳离子的是NaOH而不是Na2O,如果熔融状态下Na2O能导电,说明氧化钠是电解质,故②错误;
③二氧化硅与氢氧化钠反应生成盐与水,所以二氧化硅是酸性氧化物,故③正确;
④能使澄清石灰水变浑浊的气体是CO2和SO2,和酸反应生成CO2和SO2的离子有CO32-、SO32-、HCO3-和HSO3-,故④错误;
⑤AlCl3溶液中混有MgCl2,加入过量NaOH溶液,发生AlCl3+3NaOH=Al(OH)3↓+3NaCl、MgCl2+2NaOH=Mg(OH)2↓+2NaCl↓,Al(OH)3+NaOH═NaAlO2+2H2O,过滤后用盐酸调节溶液,往偏铝酸钠溶液中加入少量的稀盐酸,产生白色胶状的氢氧化铝沉淀,反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓,中性,为氯化钠溶液,得不到AlCl3溶液,故⑤错误;
故选B.
点评 本题考查清洁能源、电解质、酸性氧化物、离子检验等知识,掌握常见离子的检验方法以及相关概念是解答关键,题目难度不大.

| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中再分别滴加CCl4震荡静置 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| D | 将充满NO2的密闭玻热水中璃球浸泡在 | 红棕色变深 | 反应2NO2?N2O4的△H<0 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 测定溶液的酸碱度时,先将pH试纸用水润湿,后沾上被测溶液 | |
| B. | 点燃可燃性气体如H2、CO等时,先检验气体纯度后点燃 | |
| C. | 实验室稀释浓硫酸时,可以在量筒中进行 | |
| D. | 试管和烧杯都可以直接用火焰加热 |
| A. | 明矾具有消毒杀菌作用,可用于净水 | |
| B. | BaSO4在医学上用做钡餐,Ba2+对人体无毒 | |
| C. | 氢氧化铝常用于治疗胃酸过多 | |
| D. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\stackrel{催化剂}{→}$C+NO2 |
| A. | 体积减半,则压强为原来的两倍 | |
| B. | 平衡向右移动,混合气体的颜色一定会变浅 | |
| C. | 平衡向右移动,混合气体的密度不变 | |
| D. | 体积减半,压强增大,但小于原来的2倍 |
 $\stackrel{Fe_{2}O_{3}}{→}$
$\stackrel{Fe_{2}O_{3}}{→}$ +H2.
+H2.| A. | 乙苯和苯乙烯分子中均含有碳碳双健 | |
| B. | 乙苯的同分异构体共有三种 | |
| C. | 可用Br2的CCl4溶液鉴别乙苯和苯乙烯 | |
| D. | 乙苯和苯乙烯分子内所有原子有可能共平面 |
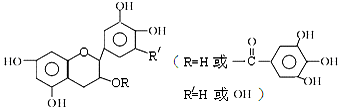
| A. | 儿茶素能与FeCl3溶液发生显色反应 | |
| B. | 1mol儿茶素最多可与10mol NaOH反应 | |
| C. | 常温下,儿茶素不溶于水,也不溶于有机溶剂 | |
| D. | 儿茶素一定不能发生水解反应 |
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | Na2O2和Na2O均可常用作呼吸面具中的供氧剂 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,是因为熬制过程发生了置换反应 | |
| D. | 古剑“沈卢”“以剂钢为刃”柔铁为蒸干,不尔则多断折”,剂钢是指铁合金 |
| A. | 控制工业废水的排放 | B. | 对河水进行消毒处理 | ||
| C. | 控制农田排水 | D. | 减少用水量 |