题目内容
医用氯化钙可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—103.0%),工艺流程为:
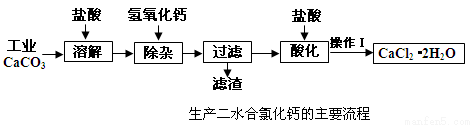
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:① ,
②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 (只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为 。
(1)CaCO3+2H+=Ca2++CO2↑+H2O(2分)
(2)①Al(OH)3、Fe(OH)3(2分),②普通漏斗(1分)
(3)除去过量的氢氧化钙(2分,合理则给分);
(4)(蒸发1分、结晶1分),(或写蒸发浓缩、降温结晶)
(5)①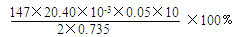 (3分)
(3分)
②Na+没除去,可能析出NaCl,导致测定结果偏大(3分,合理则给分)
【解析】
试题分析:(1)碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O;
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,所以滤渣主要成分是Al(OH)3、Fe(OH)3;
②过滤时需用的玻璃仪器有烧杯、玻璃棒、普通漏斗,所以还需要普通漏斗;
(3)因为除杂操作中氢氧化钙是过量的,所以加入盐酸将溶液的PH调节到4.0左右,其目的之一是除去过量的氢氧化钙;
(4)从溶液得到晶体,需要蒸发浓缩、降温结晶,得到氯化钙晶体;
(5)①用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL,则溶液中氯离子的物质的量是20.40×10-3L×0.05 mol/L,所以250mL溶液中CaCl2·2H2O的质量是20.40×10-3L×0.05 mol/L×10/2×147g/mol,则CaCl2·2H2O的质量分数为20.40×10-3L×0.05 mol/L×10/2×147g/mol/0.735g;
②若所测样品CaCl2·2H2O的质量百分数偏高,可能的原因是氯化钠未除去,析出氯化钠固体,导致消耗硝酸银溶液偏多,测定结果偏大。
考点:考查对工艺流程的分析,质量分数的计算,实验仪器的判断,误差分析

 阅读快车系列答案
阅读快车系列答案下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
物质 编号 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
① |
| Cu | CuO | CuSO4 | Cu(NO3)2 |
② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(NO)2 |
A.①②③④ B.①②③ C.①③④ D.②④