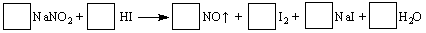题目内容
下列反应的离子方程式书写正确的是
A.澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-== CaCO3↓+H2O
B.碳酸钙溶于醋酸: CaCO3 + 2H+ =Ca2+ + CO2↑+ H2O
C.盛装氢氧化钠溶液的试剂瓶不可以用玻璃塞:SiO2+ 2Na+ +2 OH--= Na2SiO3+H2O
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
D
【解析】
试题解析:碳酸氢钠过量,生成物是碳酸钙、碳酸钠和水,故A错误;醋酸是弱酸,应写化学式,故B错误;硅酸钠是易溶于水的盐,应写离子式,故C错误;硫酸根刚好沉淀完全,则NH4HSO4和Ba(OH)2以物质的量之比1:1反应,故D正确。
考点:离子方程式正误判断

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案以下是25 ℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=a,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为 (填化学式)而除去。
(2)①中加入的试剂应该选择 为宜,其原因是 。
(3)②中除去Fe3+所发生的总反应的离子方程式为 。
(4)已知Fe(OH)3的Ksp=1×10-35mol4/L4 ;化学上通常认为残留在溶液中离子浓度小于1×10-5mol/L时,沉淀完全。方案③中a最小值为 .
(5)下列与方案③相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=a可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=a的溶液中
E.在pH>a的溶液中Fe3+一定不能大量存在