题目内容
15.下列实验操作不需要用玻璃棒的是( )| A. | 过滤 | B. | 溶解 | C. | 蒸发 | D. | 分液 |
分析 玻璃棒在很多操作中被用到,不同操作中玻璃棒的作用也不相同,在溶解中加速溶解,在过滤中引流,防止液体飞溅,在蒸发实验中玻璃棒的作用是搅拌,防止液体因局部受热而飞溅,以此解答该题.
解答 解:A.在过滤时,用玻璃棒起引流,滤纸上的药品还需用玻璃棒转移到试剂瓶中,故A不选;
B.溶解用到烧杯和玻璃棒,玻璃棒的作用是搅拌加速溶解,故B不选;
C.蒸发用玻璃棒搅拌,防止液体溅出,故C不选;
D.在分液时,用分液漏斗分液,无需玻璃棒,故D选.
故选D.
点评 本题考查化学实验基本操作中玻璃棒的使用,注意掌握玻璃棒在不同实验中的作用,题目难度不大.

练习册系列答案
相关题目
5.mg某双原子分子的气体在标准状况下的体积为V1L,其摩尔质量为Mg/mol,将其溶于水(该气体与水不反应)得到体积为V2L的溶液,NA表示阿伏加德罗常数的值,则下列错误的是( )
| A. | 该气体分子的摩尔质量为$\frac{22.4m}{{V}_{1}}$g/mol | |
| B. | 该气体分子中含有的原子数目为$\frac{{N}_{A}{V}_{1}}{22.4}$g/mol | |
| C. | 该气体溶于水后得到溶液的物质的量浓度为$\frac{m}{M{V}_{2}}$mol/L | |
| D. | 该气体溶于水后得到溶液的物质的量浓度$\frac{{V}_{1}}{22.4{V}_{2}}$mol/L |
10.工业上制取漂白粉的最初原料一般是( )
| A. | NaCl、CaCO3 | B. | CaCO3、Cl2 | C. | Cl2、Ca(OH)2 | D. | Ca(OH)2、NaCl |
7.下列各表述与示意图一致的是( )
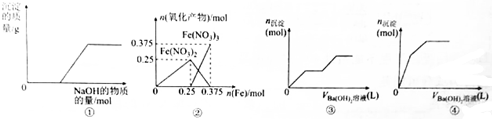

| A. | 图①表示向Ca(HCO3)2溶液中滴加NaOH溶液时,产生沉淀的质量与加入NaOH的物质的量之间的关系 | |
| B. | 图②表示向n(HNO3)=1mol的稀HNO3中加入Fe时,氧化产物(还原产物为NO)的物质的量与Fe的物质的量之间的关系 | |
| C. | 图③可用来表示向含有4mol HCl和1mol MgSO4的混合溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 | |
| D. | 图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 |
4.已知①Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓②Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑ 下列有关说法不正确是( )
| A. | 反应①是熵减小的反应,而反应②是熵增大的反应 | |
| B. | 反应②高温时能自发迸行.是由于生成CO2使熵值增大 | |
| C. | 上述事实说明的H2SiO3酸性有时比H2CO3强,有时比H2CO3弱 | |
| D. | H2CO3酸性强于H2SiO3,不能用反应②进行解释 |

