题目内容
10.氯化铁是常见的水处理剂.某氯化(FeCl3•6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3•6H2O的质量分数,实验按以下步骤进行: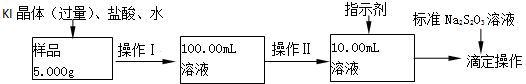
已知有关离子方程式为:2Fe3++2I-═2Fe2++I2,I2+2S2O32-═2I-+S4O62-
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻液体呈现红褐色,反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+.
(2)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有100mL容量瓶、胶头滴管(填仪器名称).
(3)操作Ⅱ必须用到的仪器是d(选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
(4)指示剂是淀粉溶液,则达到滴定终点的现象是溶液蓝色变化为无色且半分钟不褪色.
(5)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3溶液18.17mL.该样品中FeCl3•6H2O的质量分数为98.3%.
(6)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是bd(选填编号).
a.铁粉 b.氯水 c.溴水 d.双氧水.
分析 (1)氯化铁饱和溶液滴入沸水中加热生成氢氧化铁胶体;
(2)根据配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;
(3)依据流程中溶液体积的精确度可知,100.00mL的溶液需要精密量具量取;
(4)碘遇淀粉变蓝色,随标准Na2S2O3溶液滴入和碘单质反应,溶液蓝色变为无色且半分钟不褪色;
(5)依据反应的定量关系计算得到,注意溶液体积的变化;
(6)要把样品氯化铁中的少量FeCl2杂质除去,需要加入氧化剂氧化亚铁离子为铁离子,但加入的氧化剂不能引入新的杂质;
解答 解:(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,生成的是氢氧化铁胶体,反应的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(2)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,
故答案为:100mL容量瓶;胶头滴管;
(3)100.00mL的溶液需要精密量具量取,烧杯是粗略量取,量筒只能精确到0.1mL,所以用滴定管精确到0.01mL,选用滴定管量取溶液100.00mL的溶液,
故答案为:d;
(4)碘遇淀粉变蓝色,随标准Na2S2O3溶液滴入和碘单质反应,溶液蓝色变化为无色且半分钟不褪色,说明达到反应终点;
故答案为:溶液蓝色变化为无色且半分钟不褪色;
(5)2Fe3++2I-→2Fe2++I2,I2+2S2O32-→2I-+S4O62-,2FeCl3-6H2O~2Fe3+~I2~2S2O32-;滴定时,10.00ml溶液中碘单质消耗浓度为0.1000mol/L的标准Na2S2O3溶液18.17mL,FeCl3-6H2O的物质的量=0.1000mol/L×0.01817L=0.001817mol,该样品中100.00mL溶液中所含FeCl3•6H2O的物质的量为0.01817mol,质量分数=$\frac{0.01817mol×270.5g/mol}{5.0g}$×100%=98.3%;
故答案为:98.3%;
(6)要把样品氯化铁中的少量FeCl2杂质除去,需要加入氧化剂氧化亚铁离子为铁离子,但加入的氧化剂不能引入新的杂质;
a.铁粉和铁离子反应,不能和 亚铁离子反应,故a不符合;
b.氯水可以氧化亚铁离子为铁离子,且不引入新的杂质,故b符合;
c.溴水能氧化亚铁离子,但引入了溴离子,故c不符合;
d.双氧水可以氧化亚铁离子为铁离子,过氧化氢被还原为水,不引入杂质,故d符合;
故选bd;
点评 本题考查了物质组成和性质的实验验证和实验探究方法,铁及其化合物性质的分析应用,物质除杂,题目难度中等,侧重对学生应用知识的能力考查.

 阅读快车系列答案
阅读快车系列答案| A. | 在12 g单层石墨中,含六元环的数目为1NA | |
| B. | 50mL 18.4mol•L-1浓硫酸与足量铜加热充分反应,生成SO2分子的数目为0.46 NA | |
| C. | 42 g由乙烯和环丙烷组成的混合气体中,碳氢键的数目为6NA | |
| D. | 1mol过氧化钠与足量CO2充分反应,转移的电子数为2NA |
| A. | 原子半径的大小顺序:r(B)<r(C)<r(D) | |
| B. | 元素B、E的最高价氧化物的水化物都是强酸 | |
| C. | C、D的氧化物都能与氢氧化钠反应 | |
| D. | 工业上常用电解元素C、D的氯化物来制取它们的单质 |
| A. | 食盐水蒸发结晶,蒸发皿中出现大量晶体时停止加热,利用余热使溶液蒸干 | |
| B. | 金属钠着火,立即用沙土扑灭 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 实验室制取蒸馏水的装置中,冷水从冷凝管的上口进,下口出 |
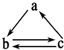 下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是( )| 物质 选项 | a | b | c |
| A | SiO2 | Na2SiO3 | H2SiO3 |
| B | C | CO | CO2 |
| C | Fe | FeCl2 | FeCl3 |
| D | CuO | Cu(OH)2 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 离子半径由大到小:Z2->X+>Y3+>W2- | |
| B. | 气态氢化物的稳定性:H2W强于H2Z | |
| C. | 工业上常采用电解法冶炼Y 单质 | |
| D. | W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
| A. | 0.5 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.2 mol•L-1 |