题目内容
1.下列说法正确的是( )| A. | 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同 | |
| B. | 同温同压下,H2(g)+Cl(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| C. | 已知:①H2(g)+O2(g)=2H2O(g)△H1=-akJ•mol-1,②2H2(g)+O2(g)=2H2O(I)△H2=-bkJ•mol-1,则a>b | |
| D. | 已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)=CO2(g)△H2=-393.0kJ•mol-1,则金刚石比石墨稳定 |
分析 A、根据强酸强碱溶解要放热,弱酸弱碱电离要吸热分析;
B、反应的焓变只与起始和终了物质状态能量有关,与变化过程,反应条件无关;
C、根据气态变成液体要放热分析;
D、根据物质的量能量越低越稳定.
解答 解:A、强酸强碱溶解要放热,弱酸弱碱电离要吸热,所以任何酸与碱发生中和反应生成1molH2O的过程中,能量变化可能不同,故A错误;
B、依据盖斯定律分析可知,反应的焓变只与起始和终了物质状态能量有关,与变化过程,反应条件无关,故B正确;
C、气态变成液体要放热,所以氢气燃烧生成液态水放出的热量多,则a<b,故C错误;
D、由①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)=CO2(g)△H2=-393.0kJ•mol-1,则①-②得,C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,金刚石能量大于石墨的总能量,物质的量能量越高越不稳定,则石墨比金刚石稳定,故D错误;
故选B.
点评 本题考查了化学反应的焓变分析,盖斯定律含义理解应用,化学反应实质分析判断,题目难度中等.

练习册系列答案
相关题目
9.氯气是一种重要的工业原料.工业上利用反应在3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A. | 该反应中氨气是还原剂 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 该反应HCl是氧化产物 | D. | 生成1molN2有6mol电子转移 |
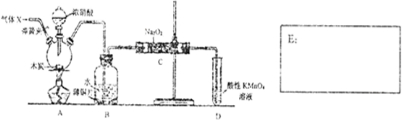
16.下列对于实验I~IV的说法正确的是( )


| A. | 实验I:逐滴滴加盐酸时,试管中立即产生大量气泡 | |
| B. | 实验Ⅱ:可比较氯、碳、硅三种元素的非金属性强弱 | |
| C. | 实验Ⅲ:从饱和食盐水中提取NaCl晶体 | |
| D. | 装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去 |
6.如表是元素周期的一部分,出了七种元素的周期表中的位置:
请用化学符号按要求回答下列问题:
(1)这七种元素中,非金属性最强的是F,在元素周期表中的位置第二周期ⅦA族
(2)元素①与②形成摩尔质量为44g/mol的物质,它的电子式是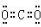
(3)③、⑥、⑦三种元素的原子半径由大到小的顺序是Al>Cl>F.
(4)④元素最高价氧化物对应的水化物与⑥元素的最高价氧化物对应的水化物反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
(5)④、⑤、⑥三种元素最高价氧化物的水化物碱性强弱顺序是NaOH>Mg(OH)2>Al(OH)3.
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)这七种元素中,非金属性最强的是F,在元素周期表中的位置第二周期ⅦA族
(2)元素①与②形成摩尔质量为44g/mol的物质,它的电子式是
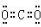
(3)③、⑥、⑦三种元素的原子半径由大到小的顺序是Al>Cl>F.
(4)④元素最高价氧化物对应的水化物与⑥元素的最高价氧化物对应的水化物反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
(5)④、⑤、⑥三种元素最高价氧化物的水化物碱性强弱顺序是NaOH>Mg(OH)2>Al(OH)3.
13.化学反应速率最主要取决于( )
| A. | 是否使用催化剂 | B. | 反应物的性质 | C. | 反应的温度 | D. | 反应的压强 |