题目内容
12.CO和CO2的混合气体18g,完全燃烧后测得CO2体积为11.2L(标况),试回答:(1)混合气体中CO质量为7g.
(2)混合气体中CO2在标况下的体积为5.6L.
分析 令CO和CO2的物质的量分别为xmol、ymol,根据二者产生二氧化碳体积可以计算碳原子的物质的量,结合元素守恒以及二者质量可以计算列方程计算解答.
解答 解:(1)令CO和CO2的物质的量分别为xmol、ymol,完全燃烧后测得CO2体积为11.2L(标况)即0.5mol,
根据二者质量及碳元素守恒,则:28x+44y=18,x+y=0.5,解得x=0.25 y=0.25,原混合气体中,CO的质量是0.25mol×28g/mol=7g,故答案为:7g;
(2)标况下,CO2的体积是0.25mol×22.4L/mol=5.6L,
故答案为:5.6L.
点评 本题考查混合物计算,侧重对物质的量有关计算考查,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
2.S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;95~100℃\;}}{\;}$S2Cl2.
反应涉及的几种物质的熔沸点如下:
 该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
(1)连接好实验装置后的第一步实验操作是检查装置的气密性.
(2)实验中需要加热的仪器是AD.(填写字母)
(3)装置B、C中的试剂分别是饱和食盐水、浓硫酸.
(4)装置D中仪器a的作用是冷凝回流、导气.
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏.
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气 体产生.用离子方程式表示产生该现象的原因ClO-+2H++Cl-=Cl2↑+H2O.
反应涉及的几种物质的熔沸点如下:
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
 该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:(1)连接好实验装置后的第一步实验操作是检查装置的气密性.
(2)实验中需要加热的仪器是AD.(填写字母)
(3)装置B、C中的试剂分别是饱和食盐水、浓硫酸.
(4)装置D中仪器a的作用是冷凝回流、导气.
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏.
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气 体产生.用离子方程式表示产生该现象的原因ClO-+2H++Cl-=Cl2↑+H2O.
3.下列各项中表达正确的是( )
| A. | 氮气的分子式:N≡N | B. | Na+结构示意图是: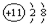 | ||
| C. | 乙醇的结构简式C2H6O | D. | HClO的电子式: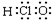 |
20.常温下,下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1 Fe(NO3)3溶液中:Mg2+、H+、SO42-、Cl- | |
| B. | 0.1 mol•L-1 KClO溶液中:Na+、H+、Cl-、NO3- | |
| C. | 0.1 mol•L-1氨水中:Ba2+、Ag+、NH4+、NO3- | |
| D. | c(OH-)=10-13 mol•L-1的溶液中:MnO4-、Na+、Br-、CH3CHO |
17.下列性质不属于金属单质通性的是( )
| A. | 一般都容易导电?导热 | B. | 都有金属光泽 | ||
| C. | 都具有较高的熔点 | D. | 一般都有延展性 |
1.下列说法正确的是( )
| A. | 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同 | |
| B. | 同温同压下,H2(g)+Cl(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| C. | 已知:①H2(g)+O2(g)=2H2O(g)△H1=-akJ•mol-1,②2H2(g)+O2(g)=2H2O(I)△H2=-bkJ•mol-1,则a>b | |
| D. | 已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)=CO2(g)△H2=-393.0kJ•mol-1,则金刚石比石墨稳定 |
 如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答:
如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答: