题目内容
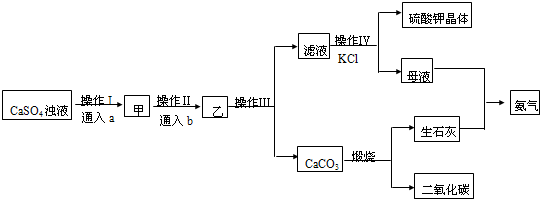
11.NaNO2被称为工业盐,在漂白、电镀等方面应用广泛,已知室温下,2NO+Na2O2?2NaNO2;制备NaNO2的装置如图所示(部分夹持装置略).另知:①3NaNO2+3HCl?3NaCl+HNO3+2NO↑+H2O;②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
请按要求回答下列问题:
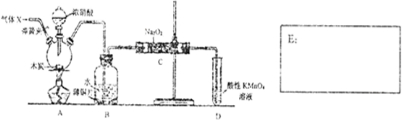
(1)检查完装置的气密性,装入药品后,实验开始前先通入一段时间气体X,X的化学式为N2,然后关闭弹簧头,再滴入浓硝酸,加热控制B中导管均匀且缓慢冒出的气泡.
(2)A烧瓶中反应的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(3)观察到装置B中的主要现象有:红棕色消失,导管口有无色气泡冒出,铜片溶解,溶液变蓝.
(4)预测C中反应开始阶段,产物除NaNO2外,还含有的副产物有Na2CO3、NaOH.欲检验C中产物所含钠盐种类,请设计环保且简约的方案,并描述预期的现象和结论:取少量样品于试管中,向其中滴加酸性高锰酸钾溶液,若高锰酸钾溶液褪色,证明有亚硝酸钠,若有使澄清石灰水变浑浊的气体产生,证明有碳酸钠.为避免产生这些副产物,应在B、C装置间增加装置E,请在右方框中画出装置E的简图,并注明其盛放的药品名称.
(5)利用改进后的装置,将3.12gNa2O2完全转化成为NaNO2,理论上至少需要木炭0.72g.
分析 A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,
(1)一氧化氮容易与空气中的氧气反应生成二氧化氮;
(2)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水;
(3)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,二氧化氮在B中与水反应生成硝酸和一氧化氮,硝酸与铜反应生成硝酸铜和一氧化氮,据此描述反应现象;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠;为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
(5)根据发生的反应①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO;③2NO+Na2O2→2NaNO2进行计算.
解答 解:(1)A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,为防止装置中空气中的氧气氧化生成的一氧化氮,应先通入氮气排尽装置内的空气,故答案为:N2;
(2)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)A中浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,二氧化氮在B中与水反应生成硝酸和一氧化氮,硝酸与铜反应生成硝酸铜和一氧化氮,所以会看到的现象为:红棕色消失,导管口有无色气泡冒出,铜片溶解,溶液变蓝,故答案为:红棕色消失,导管口有无色气泡冒出,铜片溶解,溶液变蓝;
(4)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,验证操作为:取少量样品于试管中,向其中滴加酸性高锰酸钾溶液,若高锰酸钾溶液褪色,证明有亚硝酸钠,若有使澄清石灰水变浑浊的气体产生,证明有碳酸钠;为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳,图为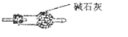 ,
,
故答案为:Na2CO3、NaOH;取少量样品于试管中,向其中滴加酸性高锰酸钾溶液,若高锰酸钾溶液褪色,证明有亚硝酸钠,若有使澄清石灰水变浑浊的气体产生,证明有碳酸钠; ;
;
(5)根据①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO;③2NO+Na2O2═2NaNO2,则有C~4NO2~$\frac{4}{3}$NO~$\frac{2}{3}$Na2O2~$\frac{4}{3}$NaNO2,所以1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭的质量为$\frac{3.12g}{78g/mol}$×$\frac{3}{2}$×12g/mol=0.72g,故答案为:0.72.
点评 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,掌握物质的性质是解题关键,题目难度较大.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| A. | 9.2g | B. | 8.6g | C. | 8g | D. | 7.4g |
反应涉及的几种物质的熔沸点如下:
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
 该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:(1)连接好实验装置后的第一步实验操作是检查装置的气密性.
(2)实验中需要加热的仪器是AD.(填写字母)
(3)装置B、C中的试剂分别是饱和食盐水、浓硫酸.
(4)装置D中仪器a的作用是冷凝回流、导气.
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏.
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气 体产生.用离子方程式表示产生该现象的原因ClO-+2H++Cl-=Cl2↑+H2O.
| A. | Na2SO3溶液【Ba(OH)2溶液】 | B. | FeCl2溶液【KSCN溶液】 | ||
| C. | KI【淀粉溶液】 | D. | NaOH溶液【Ba(OH)2溶液】 |
| A. | 氮气的分子式:N≡N | B. | Na+结构示意图是: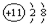 | ||
| C. | 乙醇的结构简式C2H6O | D. | HClO的电子式: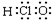 |
| A. | 0.1 mol•L-1 Fe(NO3)3溶液中:Mg2+、H+、SO42-、Cl- | |
| B. | 0.1 mol•L-1 KClO溶液中:Na+、H+、Cl-、NO3- | |
| C. | 0.1 mol•L-1氨水中:Ba2+、Ag+、NH4+、NO3- | |
| D. | c(OH-)=10-13 mol•L-1的溶液中:MnO4-、Na+、Br-、CH3CHO |
| A. | 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同 | |
| B. | 同温同压下,H2(g)+Cl(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| C. | 已知:①H2(g)+O2(g)=2H2O(g)△H1=-akJ•mol-1,②2H2(g)+O2(g)=2H2O(I)△H2=-bkJ•mol-1,则a>b | |
| D. | 已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)=CO2(g)△H2=-393.0kJ•mol-1,则金刚石比石墨稳定 |