题目内容
 由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.(1)写出Fe原子的价层电子排布式
(2)溶液中CH3COOH分子和NH3分子之间能不能形成稳定的氢键?
(3)CO2分子中碳原子的杂化轨道类型是
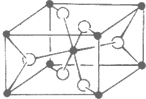
(4)TiO2的天然晶体中,最稳定的一种晶体结构如下图,黑球表示
(5)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物,该化合物中Fe2+与环戊二烯基离子之间以
考点:原子轨道杂化方式及杂化类型判断,共价键的形成及共价键的主要类型,晶胞的计算
专题:化学键与晶体结构
分析:(1)铁是26号元素,铁原子核外有26个电子,根据构造原理写出Fe原子的价层电子排布式;
(2)氢键是已经与电负性很大的原子(如N、O、F) 形成共价键的氢原子与另一个电负性很大的原子(如 N、O、F)之问的作用力;
(3)CO2分子的结构为O=C=O,根据碳原子成的σ键、孤电子对数目确定杂化轨道数目,进而确定C原子杂化方式;
单键都是σ键,双键和三键都是只有一个σ键;
(4)根据均摊法计算出验原子数目;
(5)该化合物中Fe2+与环戊二烯基离子之间以配位键结合.
(2)氢键是已经与电负性很大的原子(如N、O、F) 形成共价键的氢原子与另一个电负性很大的原子(如 N、O、F)之问的作用力;
(3)CO2分子的结构为O=C=O,根据碳原子成的σ键、孤电子对数目确定杂化轨道数目,进而确定C原子杂化方式;
单键都是σ键,双键和三键都是只有一个σ键;
(4)根据均摊法计算出验原子数目;
(5)该化合物中Fe2+与环戊二烯基离子之间以配位键结合.
解答:
解:(1)铁是26号元素,铁原子核外有26个电子,根据构造原理知Fe原子的价层电子排布式为3d64s2,故答案为:3d64s2;
(2)CH3COOH分子中H原子连接在氧原子上,NH3分子中H连接在N原子上,二者之间不能形成成稳定的氢键;故答案为:不能;
(3)CO2分子的结构为O=C=O,C原子成2个σ键键、没有孤电子对,杂化轨道数目为2,故其杂化类型为sp杂化;
单键都是σ键,双键和三键都是只有一个σ键,CH3COOH中含有3个H-C键,1个C-Cl键,1个O-C键,1个O=C键,1个H-O键,故共有7个σ键,所以1mol CH3COOH中含有的σ键的数目为7mol;
故答案为:sp;7mol;
(4)黑球的数目=8×
+1=2,白球数目=4×
+2=4,黑白球比例为1:2,故黑球是Ti,故答案为:钛(Ti);
(5)该化合物中Fe2+与环戊二烯基离子之间以间以配位键结合,Fe2+为中心原子,环戊二烯基离子作配体.故答案为:配位键.
(2)CH3COOH分子中H原子连接在氧原子上,NH3分子中H连接在N原子上,二者之间不能形成成稳定的氢键;故答案为:不能;
(3)CO2分子的结构为O=C=O,C原子成2个σ键键、没有孤电子对,杂化轨道数目为2,故其杂化类型为sp杂化;
单键都是σ键,双键和三键都是只有一个σ键,CH3COOH中含有3个H-C键,1个C-Cl键,1个O-C键,1个O=C键,1个H-O键,故共有7个σ键,所以1mol CH3COOH中含有的σ键的数目为7mol;
故答案为:sp;7mol;
(4)黑球的数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
(5)该化合物中Fe2+与环戊二烯基离子之间以间以配位键结合,Fe2+为中心原子,环戊二烯基离子作配体.故答案为:配位键.
点评:本题考查较综合,涉及氢键、分子极性的判断、核外电子排布式的书写等知识点,明确哪些元素的原子能形成氢键,难度中等.

练习册系列答案
相关题目
把固体Ca(OH)2放入蒸馏水中达到溶解平衡后:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),下列说法中正确的是( )
| A、给溶液加热,溶液中的Ca2+浓度一定增大 |
| B、恒温条件下向溶液中加入少量CaO,溶液的pH升高 |
| C、向溶液中加入少量CH3COONa晶体,则Ca(OH)2固体的质量增多 |
| D、向溶液中加入少量冰醋酸,溶液中的OH-浓度增大 |
以下数值大于或等于阿伏加德罗常数的是( )
| A、含4.8g碳元素的石墨晶体中的共价键数 |
| B、250 mL 1 mol?L-1FeCl3溶液中,阴、阳离子总数 |
| C、一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数 |
| D、在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成0.5 molCl2转移的电子数 |
下列说法正确的是( )
| A、HClO4中氯元素化合价比HClO中氯元素化合价高,所以,HClO4的氧化性强 |
| B、具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
| C、已知还原性:B->C->D-,反应2C-+D2=2D-+C2和反应 2C-+B2=2B-+C2都能发生 |
| D、已知①Fe+Cu2+=Fe2++Cu;②2Fe3++Cu=2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+ |
已知两个热化学方程式:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol.现有炭粉和H2组成的悬浮气共0.3mol,使其在O2中完全燃烧,共放出87.71kJ的热量,则炭粉与H2的物质的量之比是( )
| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
M(NO3)2热分解的反应方程式为2M(NO3)2
2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下得到2.24L氧气,则M的摩尔质量是( )
| ||
| A、24 g/mol |
| B、24 |
| C、64 g/mol |
| D、64 |
273K,1.01×105pa(标准状况下),将1.40g的氮气,1.60g的氧气和0.40g的氦气混合,该混合气体的体积是( )
| A、6.72L |
| B、3.36L |
| C、8.96L |
| D、4.48L |