题目内容
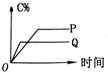
9. 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)═bM(g),M、N的物质的量随时间的变化曲线如图所示.
一定温度下,在容积为VL的密闭容器中进行反应:aN(g)═bM(g),M、N的物质的量随时间的变化曲线如图所示.(1)该反应的化学方程式中$\frac{a}{b}$=2.
(2)t1~t2时间段,以M的浓度变化表示的平均反应速率为$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1.
(3)t2时,生成M的速率与消耗N的速率不相等(填“相等”或“不相等”).
(4)下列叙述中能说明上述反应达到平衡状态的是BD.
A.反应中M与N的物质的量之比为1:1
B.混合气体的总物质的量不随时间的变化而变化
C.单位时间内每消耗a mol N,同时生成b mol M
D.N的质量分数在混合气体中保持不变.
分析 (1)根据物质的量的变化之比等于化学计量数之比求算;
(2)根据v=$\frac{△c}{△t}$计算M的平均反应速率;
(3)t2时刻MN物质的量相同,但不会的浓度不同,反应速率不同;
(4)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:(1)有图象可知,$\frac{a}{b}$=$\frac{△n(N)}{△n(M)}$=$\frac{(8-2)mol}{(5-2)mol}$=$\frac{2}{1}$=2,故答案为:2;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:v=$\frac{△c(M)}{△t}$=$\frac{\frac{(4-3)mol}{VL}}{({t}_{2}-{t}_{1})min}$=$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1,故答案为:$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1;
(3)t2时刻生成M的速率=$\frac{\frac{(5-2)mol}{VL}}{{t}_{2}min}$=$\frac{3}{{t}_{2}V}$mol/(L•min),消耗N的速率=$\frac{\frac{(8-2)mol}{VL}}{{t}_{2}min}$=$\frac{5}{{t}_{2}V}$mol/(L•min),t2时,生成M的速率与消耗N的速率不相等,
故答案为:不相等;
(4)A、当体系达平衡状态时,M与N的物质的量之比为可能时1:1,也可能不是1:1,故A错误;
B、随着反应进行,混合气体的总物质的量减小,当混合气体的总物质的量不随时间的变化而变化时,说明到达平衡状态,故B正确;
C、无论反应是否达到平衡,这个关系总是成立的,反应方向一致,不能作为平衡状态判断的依据,故C错误;
D、N的质量分数在混合气体中保持不变是平衡标志,故D正确;
故答案为:BD.
点评 本题考查较为综合,涉及化学方程式、平衡状态、反应速率的计算等问题,以基础为主,注意相关知识的积累,题目难度不大.

| A. | 2-乙基丙烷  | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. | 间二甲苯  | D. | 2-甲基-2-丙烯 |
| A. | 16O和18O的质量数相同,但是中子数不同 | |
| B. | 16O和18O核外电子排布不同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子 |
| A. | 反应C(s)+H2O(g)?CO(g)+H2(g) 的平衡常数为:K=$\frac{c(CO)•c({H}_{2})}{c(C)•c({H}_{2}O)}$ | |
| B. | 反应Cr2O72-+H2O?2CrO42-+2H+ 的平衡常数为:K=$\frac{c(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{3}^{2-})•c({H}_{2}O)}$ | |
| C. | NH4++H2O?NH3•H2O+H+的平衡常数为:K=$\frac{{K}_{W}}{{K}_{b}(N{H}_{3}•{H}_{2}O)}$ | |
| D. | 2AgI(s)+S2-(aq)?Ag2S(s)+2I-(aq)的平衡常数为:K=$\frac{{K}_{sp}(A{g}_{2}S)}{{{K}_{sp}}^{2}(AgI)}$ |
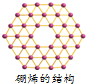
| A. | 是一种新型化合物 | B. | 与金刚石结构相似 | ||
| C. | 与${\;}_{5}^{10}$B互为同素异形体 | D. | 由共价键构成的单质 |
| A. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后,反应速率加快 | |
| B. | 镀锡铁桶的镀层破损后,破损处很快会出现破洞 | |
| C. | 轮船吃水线以下的船壳上装有一定数量的锌块 | |
| D. | 铝片不用特殊方法保存 |
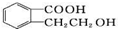 的有机物可以通过不同的反应得到下列四种物质
的有机物可以通过不同的反应得到下列四种物质①
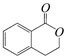 ②
②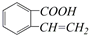 ③
③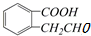 ④
④ ,
,生成这四种有机物的反应类型依次为( )
| A. | 取代反应、消去反应、酯化反应、加成反应 | |
| B. | 取代反应、消去反应、氧化反应、取代反应 | |
| C. | 酯化反应、取代反应、缩聚反应、取代反应 | |
| D. | 酯化反应、消去反应、取代反应、氧化反应 |