题目内容
4.在A(g)+B(g)═C(g)+D(g)的反应体系中,C的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q与P,则正反应是放热反应的图为( )| A. | 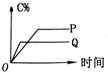 | B. | 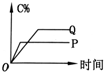 | C. | 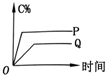 | D. | 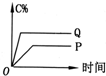 |
分析 根据平衡时C%的大小判断出平衡移动的方向,再根据温度对平衡移动的影响,进而找出正反应是放热反应的图象.
解答 解:A、因为Q线为400℃,P线为100℃,而平衡时Q线对应的C%小,即温度从100℃增大到400℃,平衡逆向移动,所以正反应为放热反应,故A正确;
B、因为Q线为400℃,P线为100℃,根据先拐先的原则,这个图象表达本身就是错误的,故B错误;
C、因为Q线为400℃,P线为100℃,而根据先拐先的原则,这个图象表达本身就是错误的,故C错误;
D、因为Q线为400℃,P线为100℃,而平衡时P线对应的C%小,即温度从100℃增大到400℃,平衡正向移动,所以正反应为吸热反应,故D错误;
故选A.
点评 本题考查化学平衡移动图象题,题目难度中等,做题时注意分析反应的特征,注意图象曲线的变化特点.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
14.25℃、101kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33kJ•g-1、143kJ•g-1、56kJ•g-1、23kJ•g-1,则下列热化学方程式正确的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-396 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-286 kJ•mol-1 | |
| D. | CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=+736kJ•mol-1 |
15.下列离子能在溶液中大量共存的是( )
| A. | Na+、NH4+、CO32-、Br- | B. | Fe2+、H+、NO3-、Cl- | ||
| C. | Al3+、Ca2+、HCO3-、SO42- | D. | Fe3+、Cu2+、NO3-、OH- |
16.NH3-O2碱性燃料电池的示意图如下,有关说法正确的是( )

| A. | 该电池总反应为:4NH3+3O2═2N2+6H2O | |
| B. | a极的电极反应为:2NH3-6e-═N2+6H+ | |
| C. | b极的电极反应为:4OH--4e-═2H2O+O2↑ | |
| D. | a极每产生1molN2,约有6×6.02×1023个OH-迁移至b极 |
 .
.
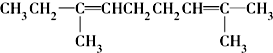 .
. .
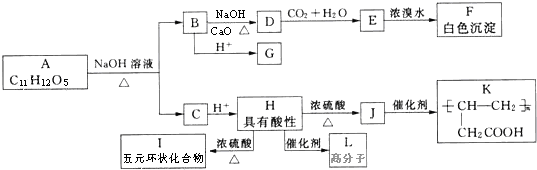
. 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)═bM(g),M、N的物质的量随时间的变化曲线如图所示.
一定温度下,在容积为VL的密闭容器中进行反应:aN(g)═bM(g),M、N的物质的量随时间的变化曲线如图所示.
 ;Y的结构简式为
;Y的结构简式为 .
.
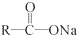 +NaOH $→_{△}^{CaO}$R-H+Na2CO3
+NaOH $→_{△}^{CaO}$R-H+Na2CO3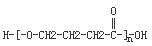 +(n-1)H2O.
+(n-1)H2O.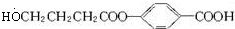 ;A生成B和C的反应方程式:
;A生成B和C的反应方程式: .
.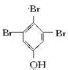 (写结构简式).
(写结构简式).