题目内容
14.利用海水资源能达到相关目标的是( )| A. | 用潮汐发电,将化学能转化为电能 | |
| B. | 不需富集,直接提取海水中的溴 | |
| C. | 用海水中的NaCl制取烧碱和纯碱 | |
| D. | 只需使海水中的碘升华就能得到碘单质 |
分析 A.根据能量转化的方式分析,朝汐能转化为电能,没有发生化学反应;
B.海水中溴元素含量较大,但海水中溴离子的浓度很小,不能直接提取,先浓缩后加入氧化剂得到低浓度溴单质溶液,用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的;
C.海水晒盐后得到固体氯化钠,电解饱和食盐水得到氯气、氢气和氢氧化钠溶液,是氯碱工业,氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体和氯化铵,碳酸氢钠受热分解制备纯碱;
D.海水中碘元素不是单质碘,是碘离子;
解答 解:A、利用朝汐发电是朝汐能转化为电能,没有发生化学反应,而化学能转化为电能必须要发生化学反应,故A错误;
B.海水中溴元素含量较大,但海水中溴离子的浓度很小,海水提取溴一般用氯气置换溴离子转化为溴单质,用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的,故B错误;
C.电解饱和食盐水得到氯气、氢气和氢氧化钠溶液,是氯碱工业,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体和氯化铵,NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,碳酸氢钠受热分解制备纯碱,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,故C正确;
D.海水中的碘元素以碘离子的形式存在,需要加入氧化剂才能获得单质碘,故D错误;
故选C.
点评 本题考查海水资源的综合利用,注意掌握中学常见的化学工业,侧重对化学与技术的考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.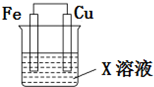 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转(指针偏转程度大),则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转(指针偏转程度大),则其可能的组合共有( )
 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转(指针偏转程度大),则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转(指针偏转程度大),则其可能的组合共有( )| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
5. 如图为氢氧燃料电池原理示意图,已知该燃料电池总反应为:2H2+O2═2H2O,a极反应为:H2+2OH--2e-═2H2O,下列叙述不正确的是( )
如图为氢氧燃料电池原理示意图,已知该燃料电池总反应为:2H2+O2═2H2O,a极反应为:H2+2OH--2e-═2H2O,下列叙述不正确的是( )
 如图为氢氧燃料电池原理示意图,已知该燃料电池总反应为:2H2+O2═2H2O,a极反应为:H2+2OH--2e-═2H2O,下列叙述不正确的是( )
如图为氢氧燃料电池原理示意图,已知该燃料电池总反应为:2H2+O2═2H2O,a极反应为:H2+2OH--2e-═2H2O,下列叙述不正确的是( )| A. | a电极是负极,发生氧化反应 | |
| B. | b电极的电极反应为4OH--4e-═2H2O+O2↑ | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 燃料电池内部H+从负极移向正极 |
2.用0.1000mol•L-1的盐酸溶液滴定未知浓度的NaOH溶液时,下列操作正确的是( )
| A. | 装碱液的锥形瓶用NaOH溶液润洗 | |
| B. | 滴定时,眼睛注视酸式滴定管中液面的下降情况 | |
| C. | 应用右手控制酸式滴定管的活塞 | |
| D. | 若用甲基橙作指示剂,到滴定终点时锥形瓶内液体为橙色 |
9.下列各组物质中属于同分异构体的是( )
| A. |  和 和 | B. | CH3CH2OH 和 CH3 CH2-O-CH2CH3 | ||
| C. |  和 和 | D. |  和 和 |
3.鉴别①NaOH;②Al2(SO4)3;③Ba(NO3)2;④FeCl3;⑤KCl五种溶液,不用其它试剂,被鉴别出来的顺序是( )
| A. | ①②③④⑤ | B. | ④③①②⑤ | C. | ④①②③⑤ | D. | ②③①④⑤ |
4.在氢氧化钾溶液中,已知钾离子与水分子的物质的量之比为a:b,溶液的密度为ρg/cm3,则溶液的浓度为( )
| A. | $\frac{39a}{18b+39a}×100%$ | B. | $\frac{1000ρa}{56a+18b}mol/L$ | ||
| C. | $\frac{a}{56a+18b}mol/L$ | D. | $\frac{56a}{56a+18b}%$ |