题目内容
5. 如图为氢氧燃料电池原理示意图,已知该燃料电池总反应为:2H2+O2═2H2O,a极反应为:H2+2OH--2e-═2H2O,下列叙述不正确的是( )
如图为氢氧燃料电池原理示意图,已知该燃料电池总反应为:2H2+O2═2H2O,a极反应为:H2+2OH--2e-═2H2O,下列叙述不正确的是( )| A. | a电极是负极,发生氧化反应 | |
| B. | b电极的电极反应为4OH--4e-═2H2O+O2↑ | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 燃料电池内部H+从负极移向正极 |
分析 氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的电极是负极,氧气易得电子发生还原反应,所以通入氧气的电极是正极;b电极上发生反应为:2H2O+O2+4e-=4OH-,结合氢氧燃料电池为绿色环保电池进行判断.
解答 解:A.氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的a极为电源的负极,故A正确;
B.氢氧燃料电池中,通入氧气的b极为原电池的正极,正极上氧气得电子发生还原反应,正确的反应为:2H2O+O2+4e-=4OH-,故B错误;
C.氢氧燃料电池的产物是水,环保无污染,是一种具有应用前景的绿色电源,故C正确;
D.a为负极、b为正极,溶液中电流从负极流向正极,则氢离子带正电荷,移动方向与电流方向相同,则氢离子从而负极移向正极,故D正确;
故选B;
点评 本题考查了原电池工作原理,题目难度不大,明确原电池正负极的判断方法为解答关键,注意熟练掌握原电池工作原理,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
15.美日三位科学家曾因对“有机物合成过程中钯催化交叉偶联”的研究获诺贝尔化学奖.评审委员会认定这项研究成果可以大大提升合成复杂化学物质的可能性.钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:CO+PdCl2+H2O═CO2+Pd↓+2HC1.对该反应的下列说法正确的是( )
| A. | CO作氧化剂,具有氧化性 | |
| B. | HCl是还原产物 | |
| C. | 反应中H2O提供了氧原子,因此H2O是氧化剂 | |
| D. | 生成22.4 L CO2(标准状况)时,转移的电子数为2NA |
16.与  互为同分异构体的酚类化合物有( )
互为同分异构体的酚类化合物有( )
 互为同分异构体的酚类化合物有( )
互为同分异构体的酚类化合物有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
13.一种烃的结构式可以表示为:

命名该化合物时,主链上的碳原子数是( )

命名该化合物时,主链上的碳原子数是( )
| A. | 9 | B. | 11 | C. | 12 | D. | 13 |
20.分子式为CnH2nO2的羧酸和某醇酯化生成分子式为Cn+2H2n+4O2的酯,反应所需羧酸和醇的质量比为1:1,则羧酸是( )
| A. | 甲酸 | B. | 乙酸 | C. | 丙酸 | D. | 乙二酸 |
17.某实验室需要少量的一氯乙烷,下列制取方法中所得产物含量最高的是( )
| A. | 等物质的量的乙烷和氯气的光照反应 | |
| B. | 乙烯与氯气的加成反应 | |
| C. | 乙烯与氢气和氯气混合反应 | |
| D. | 乙烯与氯化氢加成反应 |
14.利用海水资源能达到相关目标的是( )
| A. | 用潮汐发电,将化学能转化为电能 | |
| B. | 不需富集,直接提取海水中的溴 | |
| C. | 用海水中的NaCl制取烧碱和纯碱 | |
| D. | 只需使海水中的碘升华就能得到碘单质 |
15.第ⅦA族元素具有相似的化学性质,其原因是它们的原子具有相同的( )
| A. | 原子半径 | B. | 电子层数 | C. | 最外层电子数 | D. | 核外电子数 |
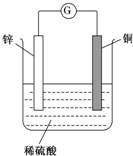 如图所示,将锌、铜通过导线相连,置于稀硫酸中.
如图所示,将锌、铜通过导线相连,置于稀硫酸中.