题目内容
18.与足量稀盐酸反应生成1molH2:耗铝的质量为18g;耗镁的质量为24g;耗铁的质量为56g;耗锌的质量为65g;耗钠的质量为46g.分析 据2Al+6HCl=2AlCl3+3H2↑,Mg+2HCl=MgCl2+H2↑,Fe+2HCl=FeCl2+H2↑,Zn+2HCl=ZnCl2+H2↑,2Na+2HCl=2NaCl+H2↑这些方程式中氢气的量进行计算.
解答 解:2Al+6HCl=2AlCl3+3H2↑
54 3
18 1
则:m(Al)=18g,
Mg+2HCl=MgCl2+H2↑
24 1
24 1
则:m(Mg)=18g,
Fe+2HCl=FeCl2+H2↑
56 1
56 1
则:m(Fe)=56g,
Zn+2HCl=ZnCl2+H2↑
65 1
65 1
则:m(Zn)=65g,
2Na+2HCl=2NaCl+H2↑
46 1
46 1
则:m(Na)=46g,
故答案为:18g;24g;56g;65g;46g.
点评 本题考查化学方程式有关计算,难度不大,正确书写化学方程式是本题解题的关键.

练习册系列答案
相关题目
6.在其他条件不变的情况下,能使合成氨反应进行程度增大的方法是( )
| A. | 升高温度 | B. | 减小压强 | C. | 使用催化剂 | D. | 及时分离出氨气 |
13.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种原理:下列说法正确的是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1═+49.0KJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H2═-192.9KJ/mol( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1═+49.0KJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H2═-192.9KJ/mol( )
| A. | CH3OH的燃烧热为192.9kJ•mol-1 | |
| B. | 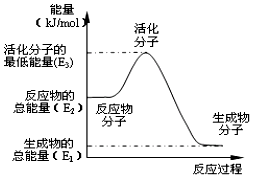 反应①中的能量变化如图所示,且△H1=E2-E1 | |
| C. | 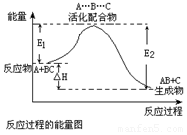 反应②中的能量变化如图所示,且△H2=E2-E1 | |
| D. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H>-192.9kJ•mol-1 |
3.下列实验中,所采取的分离方法不正确的是( )
| 选项 | 目的 | 分离方法 |
| A | 除去铜器表面的铜绿【Cu2(OH)2CO3】 | 用盐酸浸泡,用清水冲洗 |
| B | 除去乙醇中的少量水 | 加生石灰,再蒸馏 |
| C | 除去 HCl中的 C12 | 通过饱和食盐水洗气再干燥 |
| D | 除去NaCl固 体中的 NH4Cl | 加热 |
| A. | A | B. | B | C. | C | D. | D |
7.室温时,将浓度和体积分别为 c1,V1的 NaOH 溶液和 c2、V2 的 CH3COOH 溶液相混合,下列关于 该混合溶液的叙述错误的是( )
| A. | 当 pH=7 时,若 V1=V2,则一定是 c2>c1 | |
| B. | 在任何情况下都满足 c(Na+ )+c(H+ )=c(CH3COO- )+c(OH- ) | |
| C. | 若 pH>7,则一定是 c1V1>c2V2 | |
| D. | 若 V1=V2,c1=c2,则 c(CH3COO-)+c(CH3COOH)=c(Na+) |
8.下列说法不正确的是( )
| A. | 可以用丁达尔现象区分溶液和胶体 | |
| B. | 硅是良好的半导体材料,纯净二氧化硅是光导制品的基本原料 | |
| C. | SO2 使高锰酸钾褪色是利用 SO2 的漂白性 | |
| D. | 定容时俯视刻度线,会导致浓度偏高 |
 (1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为: