题目内容
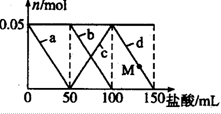 向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )| A、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)2↓ |
| B、b和c曲线表示的离子反应是相同的 |
| C、原混合溶液中CO32-与Al2-的物质的量之比为1:1 |
| D、M点时,溶液中沉淀的质量为3.9g |
考点:离子方程式的有关计算
专题:计算题
分析:Na2CO3,NaAlO2的混合溶液中加入HCl溶液,依次发生反应AlO2-+H++H2O═Al(OH)3↓、CO32-+H+═HCO3-、HCO3-+H+═CO2↑+H2O,据此解答.
解答:
解:Na2CO3,NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-减少,第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d线表示HCO3-减少,此阶段Al(OH)3不参与反应.
A.Na2CO3,NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-减少,故A正确;
B.第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,故B正确;
C.第一、第二两段消耗的盐酸的体积都是50ml,所以消耗的氯化氢的物质的量相等,依据第一阶段、第二阶段发生反应AlO2-+H++H2O═Al(OH)3↓,CO32-+H+═HCO3-,可知CO32-与AlO2-的物质的量之比为1:1,但这两种物质都是强碱弱酸盐都能水解,水解程度不同导致无法判断溶液中CO32-与AlO2-的物质的量之比,故C错误;
D.盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO32+反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)0.05mol,m(Al(OH)3)=0.05mol×78g/mol=3.9g,故D正确;
故选:C.
A.Na2CO3,NaAlO2的混合溶液中加入HCl溶液,先发生反应AlO2-+H++H2O═Al(OH)3↓,a线表示AlO2-减少,故A正确;
B.第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,b线表示CO32-减少,c线表示HCO3-的增加,故B正确;
C.第一、第二两段消耗的盐酸的体积都是50ml,所以消耗的氯化氢的物质的量相等,依据第一阶段、第二阶段发生反应AlO2-+H++H2O═Al(OH)3↓,CO32-+H+═HCO3-,可知CO32-与AlO2-的物质的量之比为1:1,但这两种物质都是强碱弱酸盐都能水解,水解程度不同导致无法判断溶液中CO32-与AlO2-的物质的量之比,故C错误;
D.盐酸50mL时NaAlO2中铝元素全部转化为氢氧化铝沉淀,加50mL盐酸之后CO32+反应,氢氧化铝沉淀不溶解,则M点沉淀的质量和盐酸50mL时沉淀的质量相同,由NaAlO2+HCl+H2O=NaCl+Al(OH)3↓知,n(Al(OH)3)=n(NaAlO2)=n(HCl)0.05mol,m(Al(OH)3)=0.05mol×78g/mol=3.9g,故D正确;
故选:C.
点评:本题考查反应与图象的关系,明确图象中各条曲线表示的物质是解本题的关键,注意碳酸根与氢离子反应的过程,题目难度中等.

练习册系列答案
相关题目
分别取下列溶液各2毫升,用水稀释到20毫升,溶液的pH 由3.0变成4.0,则该溶液是( )
(a)一元强酸(b)二元弱酸(c)一元弱酸(d)二元强酸.
(a)一元强酸(b)二元弱酸(c)一元弱酸(d)二元强酸.
| A、(a) | B、(b) |
| C、(a)(c) | D、(a)(d) |
下列化学用语或模型正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、甲烷分子的比例模型: |
C、羟基的电子式: |
| D、葡萄糖的最简式:C6H12O6 |
不能用于区别稀硫酸和浓硫酸的方法的是( )
| A、加水溶解,观察溶液温度变化 |
| B、取相同质量敞口放置,过一段时间在称量,比较质量变化 |
| C、取相同量,加入到氯化钡溶液中,观察是否有沉淀产生 |
| D、取相同量于试管中,加入铜片,加热观察,是否有刺激性气味的气体产生 |