题目内容
2.四种短周期元素X、Y、Z、W,Z与W为同主族元素,Z2-和Y+的电子层结构完全相同,已知核反应2X+3X=42He+10n(10n为中子),且X或Y与Z或W均能形成原子数目之比为1:1和2:1的二元化合物.则下列有关说法错误的是( )| A. | 熔沸点:YX>W单质>WZ2;离子半径:Z2->Y+>X3+ | |
| B. | YXWZ3中既有离子键又有共价键,其溶液存在多种平衡,溶液呈酸性 | |
| C. | Y与W形成原子数目之比为1:1化合物的电子式表示形式为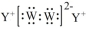 | |
| D. | X2WZ4在水中能电离:X2WZ4=2X++WZ42-,所以X2WZ4为离子化合物 |
分析 根据题意推出具体元素分别为:X-H,Y-Na,Z-O,W-S;H或Na分别与O或S可以形成H2O2、H2S2、Na2O2、Na2S2、H2O、H2S、Na2O、Na2S等二元化合物.核聚变反应方程式2H+3H=42He+10n.
A.根据NaH为离子晶体,S单质和SO2为分子晶体,则NaH熔沸点最高,常温下S单质为固态,比较熔沸点,根据电子层数越多,离子半径越大,当电子层数相同时,核电荷数越大,半径越小,比较离子半径;
B.YXWZ3中既有离子键又有共价键,在溶液中HSO3-既电离有水解,但电离大于水解;
C.Na2S2的电子式与过氧化钠类似;
D.H2SO4在水中可电离为离子,但属于共价化合物.
解答 解:根据题意推出具体元素分别为:X-H,Y-Na,Z-O,W-S;H或Na分别与O或S可以形成H2O2、H2S2、Na2O2、Na2S2、H2O、H2S、Na2O、Na2S等二元化合物.核聚变反应方程式2H+3H=42He+10n.
A.根据NaH为离子晶体,S单质和SO2为分子晶体,则NaH熔沸点最高,常温下S单质为固态,SO2为气态,故熔沸点:NaH>S单质>SO2;根据电子层数越多,离子半径越大,当电子层数相同时,核电荷数越大,半径越小,则离子半径:O2->Na+>T+(3H+),故A正确;
B.YXWZ3中既有离子键又有共价键,在溶液中HSO3-既电离有水解,但电离大于水解,溶液呈酸性,故B正确;
C.Na2S2的电子式为 ,故C正确;
,故C正确;
D.H2SO4在水中可电离为离子,但属于共价化合物,故D错误.
故选D.
点评 本题考查结构性质位置关系综合应用,推断元素是解题关键,注意元素周期律的理解掌握,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
2.M、Q、R、V为分别占有前3周期的元素.其原子序数依次增加,M和R、Q和V属于同一主族,且它们的最外层电子数之和为14,下列说法中正确的是( )
| A. | 单质的沸点:M>Q | |
| B. | Q元素的阴离子和V元素的阴离子都只有还原性 | |
| C. | M、Q、R、V四种元素组成的化合物的水溶液可以是碱性、中性和酸性 | |
| D. | Q与R可以组成2种离子化合物 |
13.《本草经集注》记载:“鸡屎矾(碱式硫酸铜或碱式碳酸铜)不入药用,惟堪镀作,以合熟铜;投苦酒(醋)中,涂铁皆作铜色,外虽铜色,内质不变”.下列说法错误的是( )
| A. | 鸡屎矾中含有极性共价键 | |
| B. | 铜盐溶液可与铁发生置换反应 | |
| C. | 碱式碳酸铜不稳定,受热易分解 | |
| D. | 鸡屎矾投苦酒中发生的是氧化还原反应 |
7.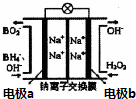 以NaBH4和H2O2为燃料的燃料电池可用于通信卫星.其负极材料采用Pt/C,正极材料采用MnO2,电池的工作原理如图所示.下列说法错误的是( )
以NaBH4和H2O2为燃料的燃料电池可用于通信卫星.其负极材料采用Pt/C,正极材料采用MnO2,电池的工作原理如图所示.下列说法错误的是( )
 以NaBH4和H2O2为燃料的燃料电池可用于通信卫星.其负极材料采用Pt/C,正极材料采用MnO2,电池的工作原理如图所示.下列说法错误的是( )
以NaBH4和H2O2为燃料的燃料电池可用于通信卫星.其负极材料采用Pt/C,正极材料采用MnO2,电池的工作原理如图所示.下列说法错误的是( )| A. | 电池放电时,Na+从a极区移向b极区 | |
| B. | 电极b采用MnO2,该极附近溶液的pH保持不变 | |
| C. | 该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O | |
| D. | 电池放电时,电子从a极经导线流向b极 |
14.下列浓度关系正确的是( )
| A. | 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+) | |
| B. | 向1L 1mol/L 的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液: c (K+)+c (H+)=6c (ClO3-)+2c (ClO-)+c (HClO)+c (OH-) | |
| C. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| D. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L |
11.明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷定,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭).下列说法不正确的是( )
| A. | 倭铅是指金属锌和铅的混合物 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的过程中有氧化还原反应发生 | |
| D. | 该冶炼锌的方法属于热还原法 |
12.下列指定反应的离子方程式正确的是( )
| A. | NO2溶于水:3NO2+H2O=2H++2NO3-+NO↑ | |
| B. | 用氨水吸收足量的SO2气体:2OH-+SO2=SO32-+H2O | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$ CH2=CH2↑+Br-+H2O | |
| D. | 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+2H2O=4Cr(OH)3↓+3CH3COO-+OH- |
 .
.
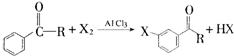
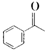 的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个.
的化学式为C8H8O,该有机物核磁共振氢谱有4种吸收峰,该分子共平面的碳原子至少有7个. 、
、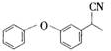 .
.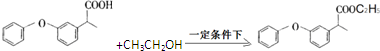 .
.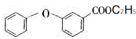 .
.