题目内容
17.下列各组原子序数的元素,能够形成A2B型离子化合物的是( )| A. | 12与17 | B. | 1与16 | C. | 11与8 | D. | 6与8 |
分析 能够形成A2B型离子化合物,则A为IA族元素,B为ⅥA族元素,并结合原子序数判断元素,以此来解答.
解答 解:A.12与17分别为Mg、Cl,可形成MgCl2离子化合物,故A不选;
B.1与16分别为H、S,可形成H2S共价化合物,故B不选;
C.11与8分别为Na、O,可形成Na2O离子化合物,故C选;
D.6与8分别为C、O,可形成CO2共价化合物,故D不选;
故选C.
点评 本题考查原子结构与元素的性质,为高频考点,把握原子序数判断元素及元素的化合价为解答的关键,侧重分析与应用能力的考查,注意短周期元素的原子序数,题目难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
7.利用Y型管与其它仪器组合可以进行许多实验(固定装置略).分析并回答下列问题:
| 实验 | 装置 |
| (1)实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为管壁内有淡黄色固体生成;硫化亚铁处加水的目的是稀释浓硫酸,防止硫化氢被氧化. |  |
| (2)实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是抬高(或移动)水准管位置,使水准管、量气管内液面相平. ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为 69.14%(保留2位小数,气体体积已折算为标况). |  |
| (3)实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是浓氨水、碱石灰(必要时可以加热),该沉淀的化学式为BaSO3. |  |
5.铝和铝合金具有许多优良的性质,用途广泛.下列用途主要是体现铝的物理性质的是( )
①制导线②盛浓硫酸的容器③包装用的铝箔④工业上冶炼金属钒、铬、锰等⑤工业制做热交换器⑥做合金用作飞机制造业材料.
①制导线②盛浓硫酸的容器③包装用的铝箔④工业上冶炼金属钒、铬、锰等⑤工业制做热交换器⑥做合金用作飞机制造业材料.
| A. | ①③⑤⑥ | B. | ②③④⑥ | C. | ①②③④⑤ | D. | ①③④⑥ |
12.下列粒子或物质中,只有氧化性的是( )
| A. | Fe2+ | B. | Fe3+ | C. | Fe3O4 | D. | FeO |
9.反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,下列说法正确是( )

| A. | 该反应是吸热反应 | |
| B. | 当反应达到平衡时,升高温度,A的转化率减小 | |
| C. | 反应体系中加入催化剂对反应热是有影响 | |
| D. | 在反应体系中加入催化剂,反应速率增大,E1和E2的变化也增大 |
6.对于反应A(g)+3B(g)?2C(g)+2D(g),下列四个数据是在不同条件下测出的该反应的化学反应速率,其中最快的是( )
| A. | v(D)=0.4mol/(L•S) | B. | v(C)=30mol/(L•min) | C. | v (B)=30mol/(L•min) | D. | v(A)=0.15mol/(L•S) |
11.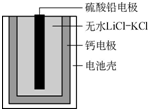 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )| A. | 该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb | |
| B. | 放电过程中,Li+向正极移动 | |
| C. | 每转移0.1mol电子,理论上生成20.7gPb | |
| D. | 常温下电解质是不导电的固体,电池不工作 |
 如图表是元素周期表的一部分,其中a、b、c、d是序号,其它为元素符号.
如图表是元素周期表的一部分,其中a、b、c、d是序号,其它为元素符号. ;
;