题目内容
18.下列各项中表达正确的是( )| A. | CO2分子的结构式:O=C=O | B. | NaCl的电子式: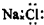 | ||
| C. | N2的结构式: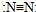 | D. | F的原子结构示意图: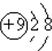 |
分析 A、二氧化碳是直线形结构,每个氧原子和碳原子形成碳氧双键;
B、氯化钠是离子化合物,根据离子化合物的电子式书写方法来写;
C、结构式是用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子;
D、F为9号元素,原子核中有9个质子,核外9个电子,分别位于3个电子层上,最外层电子有7个;
解答 解:A、二氧化碳是直线形结构,每个氧原子和碳原子形成碳氧双键,其结构式为:O=C=O,故A正确;
B、氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ,故B错误;
,故B错误;
C、N2的结构式:N≡N,故C错误;
D、F为9号元素,原子核中有9个质子,核外9个电子,其原子结构示意图为: ,故D错误.
,故D错误.
故选A.
点评 本题考查了结构式、离子化合物的电子式的书写和原子结构示意图,难度不大,注意基础的掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.将一定质量的Al2O3固体投入100mL浓度为2mol/L的盐酸溶液中得到无色透明的澄清溶液,继续向所得溶液里加入物质的量浓度1mol/L的NaOH溶液,当沉淀达到最大时,加入NaOH溶液的体积是( )
| A. | 50 mL | B. | 100 mL | C. | 200 mL | D. | 300 mL |
3.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+、K+等8种离子中的某几种.取该溶液进行实验,得到如下现象:( )
①向溶液中滴加过量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
据此可以推断:该溶液中存在的离子组可能是.
①向溶液中滴加过量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
据此可以推断:该溶液中存在的离子组可能是.
| A. | Al3+、Mg2+、SO32- | B. | K+、CO32-、I- | C. | Al3+、CO32-、I- | D. | Na+、Br-、CO32- |
10.下列分子的电子式书写正确的是( )
| A. | 氨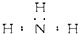 | |
| B. | 四氯化碳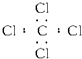 | |
| C. | 氮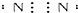 | |
| D. | 二氧化碳${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$C${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
7.下列物质性质与应用的因果关系正确的是( )
| A. | 液氨气化吸收大量热,可做制冷剂 | |
| B. | 晶体硅用于制作半导体材料是因其熔点高、硬度大 | |
| C. | 二氧化锰具有强氧化性,故能将双氧水氧化为氧气 | |
| D. | Fe比Cu活泼,所以FeCl3溶液可以腐蚀线路板上的Cu |
5.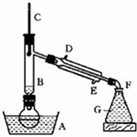 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
NaBr+H2SO4→NaHSO4+HBr
CH3CH2OH+HBr$\stackrel{硫酸}{→}$CH3CH2Br+H2O
某课外小组欲在实验室制备溴乙烷的装置如图.数据如下表.
请回答下列问题.
(1)加入药品之前须做的操作是:检查装置的气密性,实验进行的途中若发现未加入碎瓷片,其处理的方法是待冷却后重新进行操作.
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是冷凝回流.温度计的温度应控制在38.4℃~78.5℃之间.
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是SO2+2OH-=SO32-+H2O,Br2+2OH-=Br-+BrO-+H2O,此操作可在分液漏斗(填写玻璃仪器名称)中进行,同时进行分离.
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了防止溴化氢气体的挥发.
(5)粗产品中含有的主要有机液体杂质是乙醚,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行蒸馏操作.
 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4→NaHSO4+HBr
CH3CH2OH+HBr$\stackrel{硫酸}{→}$CH3CH2Br+H2O
某课外小组欲在实验室制备溴乙烷的装置如图.数据如下表.
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
(1)加入药品之前须做的操作是:检查装置的气密性,实验进行的途中若发现未加入碎瓷片,其处理的方法是待冷却后重新进行操作.
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是冷凝回流.温度计的温度应控制在38.4℃~78.5℃之间.
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是SO2+2OH-=SO32-+H2O,Br2+2OH-=Br-+BrO-+H2O,此操作可在分液漏斗(填写玻璃仪器名称)中进行,同时进行分离.
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了防止溴化氢气体的挥发.
(5)粗产品中含有的主要有机液体杂质是乙醚,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行蒸馏操作.

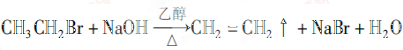 .
.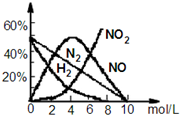 HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题:
HNO3是极其重要的化工原料.工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的. 据此完成下列试题: