题目内容
下列分子或离子的中心原子,带有一对孤对电子的是( )
| A、XeO4 |
| B、BeCl2 |
| C、CH4 |
| D、PCl3 |
考点:共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:分子中孤电子对个数=
(中心原子价电子数-配原子个数×配原子形成稳定结构需要的电子数),据此分析解答.
| 1 |
| 2 |
解答:
解:A、XeO4中Xe的孤电子对数=
(8-4×2)=0;
B、BeCl2中Be的孤电子对数=
(2-2×1)=0;
C、CH4中C的孤电子对数=
(4-4×1)=0;
D、PCl3中P的孤电子对数=
(5-3×1)=1;
所以带有一对孤对电子的是PCl3;
故选D.
| 1 |
| 2 |
B、BeCl2中Be的孤电子对数=
| 1 |
| 2 |
C、CH4中C的孤电子对数=
| 1 |
| 2 |
D、PCl3中P的孤电子对数=
| 1 |
| 2 |
所以带有一对孤对电子的是PCl3;
故选D.
点评:本题考查了化合物中孤电子对个数的计算方法,根据价层电子对互斥理论计算即可,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ |
| B、钠放入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| C、碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O |
| D、AlCl3溶液中滴加浓氨水至过量:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
将100g浓度为8mol?L-1、密度为ρ g?cm-3的氨水加入到一定量的水中,使之稀释成4mol?L-1的氨水,则需水的体积为( )
| A、小于100mL |
| B、等于100mL |
| C、大于100mL |
| D、等于100/ρ mL |
某温度下,反应2NO2?N2O4;△H<O,在密闭容器中达到平衡.平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变大了,则改变条件的可能有( )
| A、保持容器容积和温度不变,向容器内补充了NO2 |
| B、保持容器压强和温度不变,向容器内补充了N2O4 |
| C、保持容器容积和温度不变,向容器内补充了N2 |
| D、保持容器的容积不变,升高了温度 |
既能发生加氢反应,又能发生皂化反应的是( )
| A、植物油 | B、甘油 |
| C、油酸 | D、软脂酸 |
如图是两幅微观示意图,揭示了化学变化的微观实质.下列说法中正确的是( )
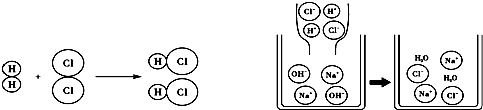

| A、该图可说明所有物质都是由分子构成的 |
| B、以上图示中未涉及置换反应 |
| C、两幅图表示的都是化合反应 |
| D、原子在化学变化中是可以再分的 |
设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1mol甲醇中含有C-H键的数目为4NA |
| B、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C、常温下,18g重水(D2O)所含的电子数为10NA |
| D、一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |