题目内容
19.我国濒临海域的省份能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中E是一种化肥,N是一种常见的金属单质.
结合上述工艺流程回答下列问题.
(1)物质G和L的化学式分别为CaCl2和H2.固体B是生活中的一种必需品,主要作用调味剂.
(2)上述工艺流程中可以循环使用的物质的化学式为CO2.
(3)反应①的化学方程式为CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;在反应①中必须先通入NH3,而后通入D,其原因是NH3在水中的溶解度大,先通入NH3,有利于吸收CO2.
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2+H2O.
(5)由K溶液经如何处理才能制得N?为防止氯化镁水解,工业上将氯化镁溶液在在氯化氢气流中蒸发结晶制得无水盐,然后再电解其熔融盐,电解的化学反应方程式MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑..
分析 根据题中提示可知C为CaO,D为CO2,固体B是生活中的一种必需品,可由海水暴晒过滤得到,推测B为NaCl;NaCl与NH3、CO2、H2O反应可由得到化肥E和沉淀F,根据侯氏制碱法知识可以推测E为NH4Cl,F为NaHCO3,母液与CaO反应得到可以煅烧的物质H,可以推知母液中参与反应的主要物质为MgCl2,H为Mg(OH)2,G为CaCl2,I为MgO,结合N是一种常见金属单质,推测N为Mg,结合题中第(5)问可以推测K为MgCl2,则M为Cl2,J为盐酸,L为H2,将推测代入流程图中检验,符合题意;
(1)根据图中的物质转化来逐步推理;
(2)煅烧贝壳时生成的气体D可以在反应①中循环使用;
(3)根据侯氏制碱法的原理书写;NH3极易溶解于水,容易吸收CO2,促进反应的进行;
(4)沉淀F为NaHCO3,受热容易分解而得到化工产品Na2CO3;
(5)K为MgCl2,属于强酸弱碱盐,蒸发结晶时,镁离子易水解而使其溶液呈酸性,应通入氯化氢抑制其水解;写出熔融氯化镁电解方程式.
解答 解:(1)根据题中提示可知C为CaO,D为CO2,固体B是生活中的一种必需品,可由海水暴晒过滤得到,推测B为NaCl;NaCl与NH3、CO2、H2O反应可由得到化肥E和沉淀F,根据侯氏制碱法知识可以推测E为NH4Cl,F为NaHCO3,母液与CaO反应得到可以煅烧的物质H,可以推知母液中参与反应的主要物质为MgCl2,H为Mg(OH)2,G为CaCl2,I为MgO,结合N是一种常见金属单质,推测N为Mg,结合题中第(5)问可以推测K为MgCl2,则M为Cl2,J为盐酸,L为H2,B为氯化钠是常用调味剂,
故答案为:CaCl2;H2;调味剂;
(2)煅烧贝壳时生成的气体D(CO2),可以在反应①中循环使用,
故答案为:CO2;
(3)固体B是氯化钠,D是CO2,二者与氨气、水反应,符合侯氏制碱法的道理,即它们反应生成碳酸氢钠和氯化铵,即CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;NH3极易溶解于水,容易吸收CO2,促进反应的进行,
故答案为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;NH3在水中的溶解度大,先通入NH3,有利于吸收CO2;
(4)沉淀F为NaHCO3,受热容易分解而得到化工产品Na2CO3,化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2+H2O;
(5)氯化镁是强酸弱碱盐,蒸发结晶时,镁离子易水解,水解离子方程式为MgCl2+H2O?Mg(OH)2+2HCl,为了防止HCl是挥发,应在氯化氢气流中蒸发结晶,从而抑制氯化镁水解;电解熔融氯化镁方程式为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:为防止氯化镁水解,工业上将氯化镁溶液在在氯化氢气流中蒸发结晶制得无水盐,然后再电解其熔融盐,电解的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
点评 本题考查了海水资源的综合应用,物质提取、物质分离等知识点,解答本类题目要抓住已知物质去逐步分析,当然在有些题目也要根据物质的颜色、生成的沉淀等推理,可以细心研究本题,总结该类题目的解题方法,做到触类旁通,题目难度中等.

 阅读快车系列答案
阅读快车系列答案完成下列实验所需选择的装置或仪器都正确的是 ( )
| A | B | C | D |
实验 | 分离植物油和氯化钠溶液 | 除去氯化钠晶体中混有的硝酸钾晶体 | 分离CCl4中的I2 | 除去CO2气体中的HCl气体 |
装置 |
|
|
|
|

| A. | 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 | |
| B. | 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应 | |
| C. | 若在含I-的滤液中加入几滴淀粉溶液,溶液变蓝色 | |
| D. | 碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取” |
| A. | 在蔗糖与稀H2SO4共热后的溶液中,滴加银氨溶液,验证产物中的葡萄糖 | |
| B. | 淀粉中加入20%H2SO4溶液在沸水浴中加热,使其水解 | |
| C. | 甘氨酸和蛋白质溶液中分别滴加0.1%茚三酮溶液并加热,溶液分别显蓝色和紫色 | |
| D. | 向淀粉水解后的溶液中加入碘水,溶液变蓝,证明淀粉尚未水解 |
| A. | SiO2 是酸性氧化物,能与NaOH溶液反应 | |
| B. | 将SO2通入BaCl2溶液可生成BaSO3沉淀 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| A. | 通入大量NO,ν正、ν逆均增大 | |
| B. | 恒温恒容下充入Ne,ν正、ν逆均不变 | |
| C. | ν正(NO)=2ν逆(N2)时,反应达到平衡 | |
| D. | n (NO):n (CO):n (N2):n (CO2)=2:2:1:2 时,反应达到平衡 |
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(2)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图1:则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.
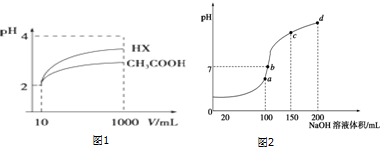
(3)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是③④⑤ (填写序号).
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤A 中有锌剩余 ⑥B中有锌剩余
(4)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液
中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).




