题目内容
【题目】用于净化汽车尾气的反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
A.装有尾气净化装置的汽车排出的气体中一定不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.提高尾气净化效率的最佳途径是研制高效催化剂
D.570K时该反应正向进行的程度很大,故使用催化剂并无实际意义
【答案】C
【解析】
A.该反应为可逆反应,不能完全转化,排出的气体中一定含有NO或CO,A错误;
B.尾气温度已经很高,再升高温度,反应速率提高有限,且消耗更多能源,意义不大,B错误;
C.研制高效催化剂可提高反应速率,解决反应极慢的问题,有利于尾气的转化,C正确;
D.570K时该反应正向进行的程度很大,但反应速率极慢,既然升高温度不切实际,应从催化剂的角度考虑,D错误。
答案选C。

 海淀黄冈名师导航系列答案
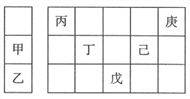
海淀黄冈名师导航系列答案【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)Y在元素周期表中的位置是___。
(2)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是___。
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为___。
(4)元素X的金属性比元素Y___(填“强”或“弱”),用原子结构的知识解释原因___。
(5)元素Q、元素Z的含量影响钢铁性能,采用如图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
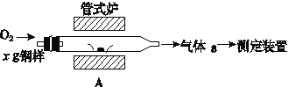
①气体a的成分是__(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是___。
【题目】下表是常温下几种常见弱酸的电离平衡常数:
弱酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | K=1.6×10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9×10-2 K2=6.4×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2S | H2S HS- | K1=9.1×10-8 K2=1.1×10-15 |
回答下列问题:
(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则由水电离出的c(H+)为___mol·L-1。
(2)下列四种离子结合H+能力最强的是___。
A.HCO3- B.C2O42- C.S2- D.CH3COO-
(3)常温下1.0mol·L-1的CH3COOH溶液中的c(H+)=___mol·L-1。
(4)常温下,加水稀释0.1mol·L-1的H2C2O4溶液,下列说法正确的是___。
A.溶液中n(H+)·n(OH-)保持不变
B.溶液中水电离的c(H+)·c(OH-)保持不变
C.溶液中![]() 保持不变
保持不变
D.溶液中c(OH-)增大
(5)将CH3COOH溶液加入少量Na2CO3溶液中,反应的离子方程式为___。