题目内容
下列叙述正确的是( )
| A、原电池中阳离子向负极移动 |
| B、用铝质铆钉接铁板,铁易被腐蚀 |
| C、粗铜精炼时,粗铜接直流电源的正极 |
| D、白铁(镀锌)的表面一旦破损,铁腐蚀加快 |
考点:原电池和电解池的工作原理,金属的电化学腐蚀与防护
专题:电化学专题
分析:A.原电池中阳离子向正极移动;
B.用铝质铆钉铆接铁板,构成原电池,Al为负极;
C.粗铜精炼时,粗铜作阳极与直流电源的正极相连;
D.白铁(镀锌)的表面一旦破损,构成原电池,Zn为负极.
B.用铝质铆钉铆接铁板,构成原电池,Al为负极;
C.粗铜精炼时,粗铜作阳极与直流电源的正极相连;
D.白铁(镀锌)的表面一旦破损,构成原电池,Zn为负极.
解答:
解:A.原电池中阳离子向正极移动,阴离子向负极移动,故A错误;
B.用铝质铆钉铆接铁板,构成原电池,Al为负极,Fe为正极,腐蚀减慢,故B错误;
C.粗铜精炼时,粗铜作阳极与直流电源的正极相连,故C正确;
D.白铁(镀锌)的表面一旦破损,构成原电池,Zn为负极,Fe的腐蚀减慢,故D错误;
故选C.
B.用铝质铆钉铆接铁板,构成原电池,Al为负极,Fe为正极,腐蚀减慢,故B错误;
C.粗铜精炼时,粗铜作阳极与直流电源的正极相连,故C正确;
D.白铁(镀锌)的表面一旦破损,构成原电池,Zn为负极,Fe的腐蚀减慢,故D错误;
故选C.
点评:本题考查原电池的工作原理,明确金属活泼性及原电池的负极易被腐蚀为解答的关键,注意电极判断的考查,题目难度不大.

练习册系列答案
相关题目
可逆反应A+B(s)?C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论正确的是( )
| A、正反应为放热反应 |
| B、正反应为吸热反应 |
| C、A为气体,C为固体 |
| D、A为固体,C为气体 |
下列实验基本操作正确的是( )
| A、用碱式滴定管量取0.10 mol?L-1的Na2CO3溶液22.10 mL |
| B、配制一定浓度的氢氧化钠溶液时,将氢氧化钠固体放在纸片上称量 |
| C、用广范pH试纸测某HCl溶液pH=3.6 |
| D、用玻璃棒蘸取HCl溶液滴到湿润的pH试纸上,测其pH |
用下列实验装置进行相应实验,能达到实验目的是( )
A、 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
B、 制取少量乙烯气体 |
C、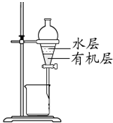 分离CCl4萃取溴水后已分层的有机层和水层 |
D、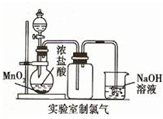 装置制取少量Cl2气体 |
在铁和铜的混合物中加入一定量的稀硝酸,充分反应后剩余金属的质量为m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属的质量为m2g,则m1与m2的关系是( )
| A、m1>m2 |
| B、m1≤m2 |
| C、m1≥m2 |
| D、m1=m2 |
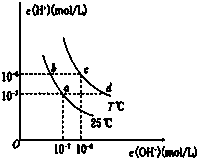 如图表示水溶液中c(H+)与c(OH-)的关系.
如图表示水溶液中c(H+)与c(OH-)的关系.