题目内容
某含有少量 FeCl2杂质的 FeCl3样品,现要测定其中铁元素的含量.实验步骤如下:
①准确称量mg 样品;
②向样品中加人 10mL 5mol?L一1的盐酸,再加人蒸馏水,配制成 250mL 溶液; ③量取 25mL 操作 ②中配得的溶液,加人 3mL 溴水,加热使之完全反应;
④趁热迅速加人质量分数为 10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤后反复灼烧、冷却、称量至恒重.
请根据上面的叙述回答:
(1)溶解样品时要加人盐酸,其目的是
(2)配制 250mL 溶液时,除需玻璃棒、烧杯外,还须用到的玻璃仪器是
(3)加人溴水时发生反应的离子方程式是:
(4)若坩埚质量为W1 g,增锅与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是 .
①准确称量mg 样品;
②向样品中加人 10mL 5mol?L一1的盐酸,再加人蒸馏水,配制成 250mL 溶液; ③量取 25mL 操作 ②中配得的溶液,加人 3mL 溴水,加热使之完全反应;
④趁热迅速加人质量分数为 10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤后反复灼烧、冷却、称量至恒重.
请根据上面的叙述回答:
(1)溶解样品时要加人盐酸,其目的是
(2)配制 250mL 溶液时,除需玻璃棒、烧杯外,还须用到的玻璃仪器是
(3)加人溴水时发生反应的离子方程式是:
(4)若坩埚质量为W1 g,增锅与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据Fe2+、Fe3+能发生水解;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答;
(3)根据单质溴具有氧化性,能氧化Fe2+生成Fe3+;
(4)若坩埚质量是Wg,坩埚与最终灼烧后的固体总质量是W2 g则生成的氧化铁质量为(W2-W1)g,依据氧化铁化学式计算25ml溶液中铁元素质量,换算250ml中含有铁元素质量计算含量;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答;
(3)根据单质溴具有氧化性,能氧化Fe2+生成Fe3+;
(4)若坩埚质量是Wg,坩埚与最终灼烧后的固体总质量是W2 g则生成的氧化铁质量为(W2-W1)g,依据氧化铁化学式计算25ml溶液中铁元素质量,换算250ml中含有铁元素质量计算含量;
解答:
解:(1)Fe2+、Fe3+能发生水解,加入盐酸可抑制水解,故答案为:抑制Fe2+、Fe3+的水解;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故答案为:250ml容量瓶、胶头滴管、量筒;
(3)单质溴具有氧化性,能氧化Fe2+生成Fe3+:2Fe2++Br2=2Fe3++2Br-;
故答案为:2Fe2++Br2=2Fe3++2Br-;
(4)若坩埚质量是W1g,坩埚与最终灼烧后的固体总质量是W2 g,则生成的氧化铁质量为(W2-W1)g,25ml溶液中铁元素的质量=
×2×56=
g;250ml溶液中铁元素的质量=
g,样品中铁元素的质量分数=
×100%=
%;
故答案为:
%;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故答案为:250ml容量瓶、胶头滴管、量筒;
(3)单质溴具有氧化性,能氧化Fe2+生成Fe3+:2Fe2++Br2=2Fe3++2Br-;
故答案为:2Fe2++Br2=2Fe3++2Br-;
(4)若坩埚质量是W1g,坩埚与最终灼烧后的固体总质量是W2 g,则生成的氧化铁质量为(W2-W1)g,25ml溶液中铁元素的质量=
| W2-W1 |
| 160 |
| 112(W2-W1) |
| 160 |
| 1120(W2-W1) |
| 160 |
| ||
| mg |
| 700(W2-W1) |
| m |
故答案为:
| 700(W2-W1) |
| m |
点评:本题主要考查了铁元素的质量分数的测定,溶液配制步骤和实验过程分析判断,考查了实验知识,和物质组成测定质量分数的计算,难度中等.

练习册系列答案
相关题目
接触法制硫酸时,煅烧黄铁矿产生的气体混合物中各成分的最佳体积分数分别为:N282%,O211%,S027%.若该混合气体经接触室发生反应后,气体体积变为原来的96.7%.若设反应前后的压强和温度不变,则消耗O2的体积分数为( )
| A、7.7% | B、6.6% |
| C、5.5% | D、3.3% |
用移液管取10mL烧碱溶液注入25mL洁净的碱式滴定管中,则液面读数应( )
| A、在10-15mL之间 |
| B、恰好在15mL处 |
| C、小于15mL |
| D、大于15mL |
室温时,下列各表述与示意图一致的是( )


| A、图甲表示在纯水中加人0.0lmol.L-1NaOH溶液,Kw与NaOH溶液体积变化关系 | ||
B、图乙表示将1 mol?L-1 CH3COONa溶液加水稀释,溶液中
| ||
C、图丙表示0.1mol?L-1NH3?H2O加水稀释,溶液中
| ||
| D、图丁表示100 mLpH=2的HCl和CH3COOH加水稀释到1000 mL时pH变化与水的体积的变化关系 |
下列叙述正确的是( )
| A、原电池中阳离子向负极移动 |
| B、用铝质铆钉接铁板,铁易被腐蚀 |
| C、粗铜精炼时,粗铜接直流电源的正极 |
| D、白铁(镀锌)的表面一旦破损,铁腐蚀加快 |
工业上获得大量的乙烯、丙烯、1,3-丁二烯采用的方法是( )
| A、煤高温干馏 | B、石油减压分馏 |
| C、石油裂化 | D、石油裂解 |
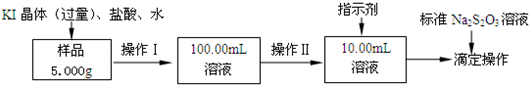
 氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行:
氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行: